题目内容
11.化学中常借助图象来表示某种变化过程,有关下列图象的说法正确的是( )| A. |  如图表示改变某化学平衡体系的温度时,反应速率随时间的变化情况 | |
| B. |  如图表示向稀盐酸中滴加氢氧化钠溶液时,溶液pH的变化情况 | |
| C. | 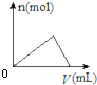 如图向氯化铝溶液中滴加氨水时,生成沉淀的物质的量变化情况 | |
| D. |  如图表示△H<0的可逆反应,化学平衡常数随温度的变化情况 |
分析 A、改变某化学平衡体系的温度时,如果升高温度,正、逆反应速率都在原平衡点的上方,如果降低温度,正、逆反应速率都在原平衡点的下方;
B、向稀盐酸中滴加氢氧化钠溶液时,开始PH小于7,后随着氢氧化钠的增加,PH渐增,最终大于7;
C、随着氨水的滴加,发生Al3++3NH3•H2O═Al(OH)3↓+3NH4+,沉淀量渐增,当铝离子完全沉淀时,沉淀量达最大值,再加氨水沉淀不溶解;
D、平衡常数是温度的函数,当正反应是放热反应时,温度越高K越小.
解答 解:A、改变某化学平衡体系的温度时,如果升高温度,正、逆反应速率都在原平衡点的上方;如果降低温度,正、逆反应速率都在原平衡点的下方,不可能一上一下,故A错误;
B、向稀盐酸中滴加氢氧化钠溶液时,开始PH小于7,后随着氢氧化钠的增加,PH渐增,最终大于7,故B正确;
C、氢氧化铝是不溶于弱酸弱碱的,随着氨水的滴加,发生Al3++3NH3•H2O═Al(OH)3↓+3NH4+,沉淀量渐增,当铝离子完全沉淀时,沉淀量达最大值,再加氨水沉淀不溶解,故C错误;
D、化学平衡常数只是温度的函数,当正反应是放热反应时,升温平衡向逆反应方向移动,所以温度越高K越小,故D错误;
故选B.
点评 本题以图象题的形式考查镁铝化合物的性质,题目难度中等,清楚发生的反应是解题关键,注意基础知识的掌握.

练习册系列答案
相关题目
2.下列反应中,不属于取代反应的是( )
| A. | 向苯酚中滴加浓溴水 | B. | 甲苯与浓硝酸、浓硫酸混合共热 | ||
| C. | 甲烷与氯气混合后见光 | D. | 乙醇与浓硫酸混合加热至170℃ |
19.下列实验装置或操作不符合实验要求的是( )
| A. | 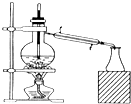 石油分馏 | B. | 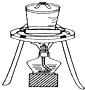 灼烧干海带 | ||
| C. | 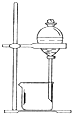 用CCl4提取碘水中的碘 | D. |  冶炼金属铁 |
16.以下变化是熵减小过程的是( )
| A. | 碳酸氢钠受热分解 | B. | 氨气与氯化氢气体反应 | ||
| C. | C(s,石墨)+H2O(g)═CO(g)+H2(g) | D. | 液态水气化 |
3.下列关于溶液中的描述正确的是( )
| A. | 常温时,NaNO2溶液的pH=8,则该溶液中c(Na+)-c(NO2-)=9.9×10-7mol•L-1 | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性的离子方程式为:H++SO42++Ba2++OH-═BaSO4↓+H2O | |
| C. | 常温下物质的量浓度相等的下列四种溶液:①NH4HSO4;②CH3COONH4;③NH4Cl;④NH4Fe(SO4)2,四种溶液中c(NH4+)比较:②>①>④>③ | |
| D. | 常温下$\frac{Kw}{c({H}^{+})}$=1×10-10mol•L-1的溶液:Na+、K+、SiO32-、NO3-可以常量共存 |
20.下列有关实验原理、方法和结论都正确的是( )
| A. | 向某溶液中加入盐酸酸化的氯化钡溶液有白色沉淀生成,该溶液中一定含SO42- | |
| B. | 向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解 | |
| C. | 除去苯中含有的苯酚,可先加NaOH溶液,充分反应后静置分液 | |
| D. | 淀粉和稀硫酸混合加热一段时间后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经完全水解 |
 .
.