题目内容
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。
基态Co原子核外电子排布式为___________________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为___________________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。在CO分子中,σ键与π键数目之比为_________。
(3)铁与K2O、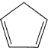 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(4)与铁同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种,往其溶液中加BaCl2溶液时,有白色沉淀;加入AgNO3溶液时,没有沉淀生成;加入氢氧化钠溶液时,无气体生成。则此种配合物的化学式为 _________________________。
(5)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
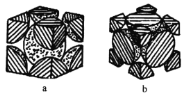
在图a所示堆积方式里铁原子的堆积方式为___________________________。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为(空间利用率)_________。
【答案】[Ar]3d74s2 < 正四面体 1:2 3 分子 [Co(NH3)5Br]SO4 体心立方堆积 ![]()
【解析】
(1)Co为27号元素,根据构造原理写出原子核外电子排布式;
Co3+核外电子排布为不稳定结构3d6、较易失去电子,Fe3+核外电子排布为半满稳定结构3d5,较难失电子,由此比较第4电离能;
PO43-中P原子孤电子对数为0、σ键数目为4,由此确定空间构型;
(2)价电子数和原子数相等的粒子互为等电子体;CO与N2的结构相似,σ键、π键数分别为1、2;
(3)在环戊二烯中有4个C原子为sp2杂化,1个C原子为sp3杂化,C5H5 - 五个C拿出5个电子再加上负离子一个电子,所以一共有六个电子,配位数为3;二茂铁的熔点不高、溶解性情况包括能升华等性质与分子晶体相似;即二茂铁由分子构成,是共价化合物,属于分子晶体;
(4)根据配合物的性质确定其内界和外界;
(5)图a晶胞为体心立方堆积,设晶胞棱长为x,则4rpm=![]() x,求出x;
x,求出x;
图b晶胞为面心立方最密堆积,设b晶胞棱长为y,Fe原子半径为R,4R=![]() y,再结合球体积公式计算。
y,再结合球体积公式计算。
(1)Co为27号元素,原子核外电子排布式为[Ar]3d74s2;
Co3+核外电子排布为不稳定结构3d6、较易失去电子,第四电离能较小;而Fe3+核外电子排布为半满稳定结构3d5,较难失电子,所以第4电离能较大;
PO43-中P原子孤电子对数为0、σ键数目为4,所以PO43-的空间构型为正四面体;
故答案为:[Ar]3d74s2,<,正四面体;
(2)CO的价电子数为(4+6)=10,原子数为2,N2的价电子数为10=5×2,所以CO的等电子体为N2 等;CO与N2的结构相似,根据N2的结构式N≡N可知,CO分子中含有一个σ键、两个π键数,所以在CO分子中,σ键与π键数目之比为1:2;
故答案为:1:2;
(3)在环戊二烯中有4个C原子为sp2杂化,1个C原子为sp3杂化,C5H5 - 五个C拿出5个电子再加上负离子一个电子,所以一共有六个电子,配位数为3;根据二茂铁的熔点不高、溶解性情况、能升华等性质与分子晶体相似,即二茂铁由分子构成,是共价化合物,属于分子晶体;
故答案为:3;分子;
(4)与铁同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种,往其溶液中加BaCl2溶液时,有白色沉淀,说明硫酸根离子在处界;加入AgNO3溶液时,没有沉淀生成,说明Br在内界;加入氢氧化钠溶液时,无气体生成,说明氨在内界。则此种配合物的化学式为[Co(NH3)5Br]SO4,故答案为:[Co(NH3)5Br]SO4;
(5)图a晶胞为体心立方堆积,设图a晶胞棱长为x,4rpm=![]() x,x=
x,x=![]() r×10-10cm;
r×10-10cm;
设图b晶胞棱长为y,Fe原子半径为R,晶胞中Fe数目为8×![]() +6×
+6×![]() =4,4R=
=4,4R=![]() y,R=
y,R=![]() ,球体积V=
,球体积V=![]() πR3=
πR3=![]() π×(
π×(![]() )3,原子的总体积占晶体体积的比例=
)3,原子的总体积占晶体体积的比例= ×100%=
×100%=![]() ;
;
故答案为:体心立方堆积;![]() 。
。

【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
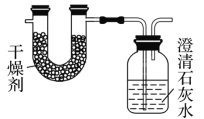
实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
(石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据完成下列问题:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为________g。
(2)生成的二氧化碳中碳元素的质量为________g。
(3)该燃料中碳元素与氢元素的质量比为________。
(4)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________________。
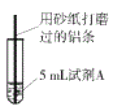
【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
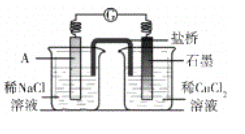
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。