题目内容
【题目】某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,该溶液中氯离子的物质的量浓度为( )
A.0.5 mol·L-1B.2 mol·L-1
C.2.5 mol·L-1D.5 mol·L-1
【答案】D
【解析】
根据镁离子的质量分数计算氯化镁的质量分数,进而根据c=![]() 计算氯化镁的物质的量浓度,根据化学式的组成可知:c(Cl-)=2c(MgCl2),据此计算出该溶液中Cl-的物质的量浓度。
计算氯化镁的物质的量浓度,根据化学式的组成可知:c(Cl-)=2c(MgCl2),据此计算出该溶液中Cl-的物质的量浓度。
MgCl2中Mg离子的质量分数为![]() ,溶液中镁离子的质量分数为5.1%,则溶液中氯化镁的质量分数为:
,溶液中镁离子的质量分数为5.1%,则溶液中氯化镁的质量分数为:![]() =20.2%,溶液中氯化镁的物质的量浓度为:c=
=20.2%,溶液中氯化镁的物质的量浓度为:c=![]() mol·L-1≈2.5mol·L-1,则该溶液中Cl-的物质的量浓度为:c(Cl-)=2c(MgCl2)=2×2.5mol·L-1=5mol·L-1,
mol·L-1≈2.5mol·L-1,则该溶液中Cl-的物质的量浓度为:c(Cl-)=2c(MgCl2)=2×2.5mol·L-1=5mol·L-1,
故选D。

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
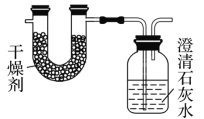
实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
(石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据完成下列问题:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为________g。
(2)生成的二氧化碳中碳元素的质量为________g。
(3)该燃料中碳元素与氢元素的质量比为________。
(4)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________________。