题目内容
【题目】乳酸亚铁{[CH3CH(OH)COO]2Fe·3H2O,Mr=288}是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O―→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2===4Fe(OH)3+4CO2。
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:

回答下列问题:
(1)NH4HCO3盛放在装置______________中(填字母),该装置中涉及的主要反应的离子方程式为____________________________________________________________________。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是__________________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75 ℃下搅拌反应。铁粉的作用是__________________________________ 。反应结束后,无需过滤,除去过量铁粉的方法是________________________________。
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是_____________________________________。经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880 g产品配成100 mL溶液,每次取20.00 mL进行必要处理,用0.100 0 mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70 mL。滴定反应如下:Ce4++Fe2+===Ce3++Fe3+,则产品中乳酸亚铁的质量分数为________。
【答案】 C Fe2++2HCO![]() ===FeCO3↓+CO2 ↑+H2O 待D处的气体纯净后关闭活塞3、打开活塞2 防止+2价的铁元素被氧化 加入适量乳酸让铁粉反应完全 乳酸根离子被酸性KMnO4氧化 98.50%
===FeCO3↓+CO2 ↑+H2O 待D处的气体纯净后关闭活塞3、打开活塞2 防止+2价的铁元素被氧化 加入适量乳酸让铁粉反应完全 乳酸根离子被酸性KMnO4氧化 98.50%
【解析】试题分析:(1)B装置是铁与盐酸反应制FeCl2,很明显NH4HCO3盛放在装置C中(填字母),该装置中涉及的主要反应的离子方程式:Fe2++ 2HCO3-![]() FeCO3
FeCO3![]() + CO2↑ + H2O
+ CO2↑ + H2O
(2)利用生成的氢气产物的压强将B中的FeCl2溶液压入到C装置中与NH4HCO3溶液混合,实际操作是:待C中空气完全除去后,关闭活塞3、打开活塞2。
(3)FeCO3易氧化,加入少量铁粉的作用是将氧化生成的Fe3+重新还原成Fe2+;反应结束后,无需过滤,可加入适量的乳酸溶解过量铁粉。
(4)测定结果偏高,应该考虑还有能与KMnO4反应的还原性的物质,譬如考虑乳酸根离子被酸性KMnO4氧化。
每次取20.00mL,进行必要处理,用0.1000mol·![]() Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70mL。
Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70mL。
可知100ml需要19.70×5 mL,此时溶液里Ce4+的物质的量为19.70×5×10-3×0.1000mol,则产品中乳酸亚铁的质量分数:19.70×5×10-3×0.1000mol×288g/mol÷2.88×100%=98.5%

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.
(1)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(﹣NH2)和(写结构简式).
(2)发育出现障碍,患营养缺乏症,这主要是由于摄取(填“蛋白质”“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是(填字母).A.菠菜B.花生油 C.瘦肉D.西瓜
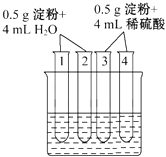
(3)如图所示4支试管同时水浴加热4min,为检验其中淀粉的水解程度,某同学的实验操作与现象记录如下:
编号 | 操作 | 现象 |
1 | 加入碘水 | 溶液变成蓝色 |
2 | 加入银氨溶液,水浴加热 | 未出现银镜 |
3 | 加入碘水 | 溶液变成蓝色 |
4 | 加入银氨溶液,水浴加热 | 未出现银镜 |
结合试管1、2中的现象,得出的结论是这两支试管中淀粉水解(填“没有”“部分”或“全部”).结合试管3、4中的现象,不能得出“这两支试管中淀粉没有水解”的结论,理由是 .