题目内容
【题目】下列装置能达到实验目的的是
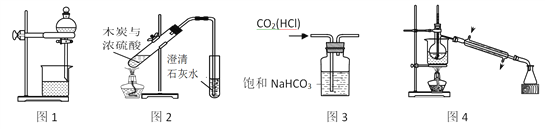
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
【答案】C
【解析】A、酒精和水任意比互溶,不能用分液的方法分离,选项A不能达到实验目的;B、木炭与浓硫酸的反应产物中含有CO2、SO2,两者都能使澄清石灰水变浑浊,选项B不能达到实验目的;C、盐酸的酸性比碳酸强,HCl气体与NaHCO3容易反应生成NaCl、CO2气体和H2O,用饱和碳酸氢钠溶液洗气能除去CO2中混有的少量HCl,选项C能达到实验目的;D、制备蒸馏水时温度计应置于蒸馏烧瓶支气管口中央,冷凝水应下进上出,选项D不能达到实验目的。答案选C。

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目