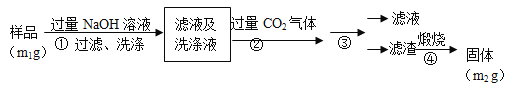
题目内容
【题目】已知25℃时Ksp[Al(OH)3]=1.0×10﹣33 , Ksp[Fe(OH)3]=4.0×10﹣38 . 向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如下图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( ) 
A.原混合溶液中c(Fe3+):c(Al3+)=1:1
B.Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去
C.B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104
D.C点溶液中的溶质只有NaAlO2
【答案】C
【解析】解:A、根据题意可知,OA段生成Fe(OH)3沉淀,AB段生成Al(OH)3沉淀,二者消耗NaOH溶液的体积比为2:3,所以原混合溶液中c(Fe3+):c(Al3+)=2:3,故A错误;B、Fe(NO3)3溶液中混有杂质Al(NO3)3加入过量的NaOH溶液,生成Fe(OH)3沉淀,没有Fe(NO3)3 , 故B错误;
C、当两种沉淀共存时,由于Ksp[Al(OH)3]=c(Al3+)c3(OH﹣),Ksp[Fe(OH)3]=c(Fe3+)c3(OH﹣),所以c(Al3+):c(Fe3+)=Ksp[Al(OH)3]:Ksp[Fe(OH)3]=2.5×104 , 故C正确;
D、C点时溶液中的溶质主要有NaAlO2、NaNO3等,故D错误;
故选C.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目