题目内容
9.下列叙述正确的是( )| A. | H2S和CS2分子都是含极性键的极性分子 | |
| B. | 在石墨晶体中,共价键与碳原子的个数比为2:3 | |
| C. | 熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
分析 A.不同非金属元素之间易形成极性键,正负电荷重心不重合的分子为极性分子;
B.石墨晶体中,每个碳原子含有共价键个数=$\frac{1}{2}×3$=1.5;
C.原子晶体中熔沸点高低与键长成反比;
D.中心原子化合价的绝对值+最外层电子数=8,该分子中所有原子都达到8电子稳定结构,但氢化物除外.
解答 解:A.不同非金属元素之间易形成极性键,正负电荷重心不重合的分子为极性分子,H2S和CS2分子中都只含极性键,前者是V形结构、后者是直线形结构,所以后者是非极性分子,故A错误;
B.石墨晶体中,每个碳原子含有共价键个数=$\frac{1}{2}×3$=1.5,所以在石墨晶体中,共价键与碳原子的个数比为1.5:1=3:2,故B错误;
C.原子晶体中熔沸点高低与键长成反比,这几种物质都是原子晶体,且键长C-C<C-Si<Si-Si,所以熔点由高到低的顺序是:金刚石>碳化硅>晶体硅,故C正确;
D.中心原子化合价的绝对值+最外层电子数=8,该分子中所有原子都达到8电子稳定结构,但氢化物除外,PCl3中P原子化合价的绝对值+最外层电子数=5+5=10、BCl3分子中B原子化合价的绝对值+最外层电子数=3+3=6,所以PCl3和BCl3分子中所有原子的最外层都不达到8电子稳定结构,故D错误;
故选C.
点评 本题考查晶体熔沸点判断、分子极性判断、8电子稳定结构判断等知识点,综合性较强,难点是8电子稳定结构判断,会根据价层电子对互斥理论确定分子空间构型,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
19.下列说法中正确的是( )
| A. | 如果找到合适的催化剂,就能够在不消耗能源的条件下从水中获得氢气 | |
| B. | 放热反应中反应物的总能量比生成物的总能量低 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 吸热反应在不加热的条件下也能发生 |
20.关于CO2说法正确的是( )
| A. | 碳原子采取sp1杂化 | B. | CO2是正四面体型结构 | ||
| C. | 干冰是原子晶体 | D. | CO2为极性分子 |
17.下列反应体系中,不属于可逆反应的是( )
| A. | SO2与水反应 | |
| B. | 氨气与水反应 | |
| C. | 工业合成氨 | |
| D. | 水电解生成H2和O2与H2在O2中燃烧生成H2O |
14.下列表述正确的是( )
| A. | 一氯甲烷的结构式CH3Cl | B. | 丙烷分子的球棍模型 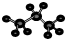 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 苯的分子式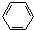 |
1.下列说法正确的是( )
| A. | F、Cl、Br、I最高价氧化物对应水化物的酸性依次减弱 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 元素原子的最外层电子数等于元素的最高化合价 | |
| D. | Na、Mg、Al失电子能力和最高价氧化物对应水化物的碱性均依次减弱 |
19.向溴水、溴的四氯化碳溶液中分别通入丙烯,下列判断正确的是( )
| A. | 反应现象相同,反应类型相同 | B. | 反应现象相同,反应类型不同 | ||
| C. | 反应现象不同,反应类型相同 | D. | 反应现象不同,反应类型不同 |
 在一体积为10L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O浓度变化如图所示:
在一体积为10L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O浓度变化如图所示: .
.