题目内容
【题目】一定条件下进行反应:COCl2(g)![]() Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是( )
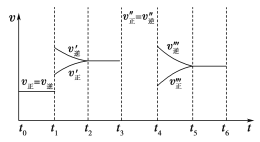
A.保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B.若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.60 mol CO,反应达到平衡前的速率:v(正)>v(逆)
D.保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%
【答案】D
【解析】
试题分析:A.由表中数据可知,6s、8s时氯气的物质的量都是0.4mol,说明6s时反应到达平衡,平衡时氯气的浓度为0.2mol.L,升高温度,到达新平衡,氯气的浓度变为0.22mol/L,氯气浓度增大,说明平衡向正反应方向移动,故正反应为吸热反应,即△H>0,故A错误;B.正反应为吸热反应,恒容绝热密闭容器进行该反应,随反应进行温度降低,而平衡常数只受温度影响,故平衡常数一定发生变化,故B错误;C.平衡时c(Cl2)=0.2mol/L,
COCl2(g)![]() Cl2(g)+CO(g)
Cl2(g)+CO(g)
起始(mol/L):0.5 0 0
转化(mol/L):0.2 0.2 0.2
平衡(mol/L):0.3 0.2 0.2
该温度下平衡常数k=![]() =0.013,
=0.013,
若起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,此时Qc=![]() =0.15>0.13,则反应向逆反应方向移动,反应达到平衡前v正<v逆,故C错误;D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,达到平衡时Cl2的转化率=
=0.15>0.13,则反应向逆反应方向移动,反应达到平衡前v正<v逆,故C错误;D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,达到平衡时Cl2的转化率=![]() ×100%=60%,如加入1.0 mol Cl2和0.8 mol CO,相当于在原来的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率减小,则Cl2的转化率小于60%,故D正确,故选D。
×100%=60%,如加入1.0 mol Cl2和0.8 mol CO,相当于在原来的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率减小,则Cl2的转化率小于60%,故D正确,故选D。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案