��Ŀ����
(12��)�����Ϊ2L�Ĺ̶��ܱ�������ͨ��3molX����,��һ���¶��·������·�Ӧ��
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
��1����5min��Ӧ�ﵽƽ��,��ʱ��������ڵ�ѹǿΪ��ʼʱ��1.2��,����Y�����ʵ���Ũ�ȱ仯��ʾ������Ϊ ��
��2����������Ӧ�ڼס��ҡ��������ĸ�ͬ�����ܱ������н���,��ͬһ��ʱ���ڲ�������ڵķ�Ӧ���ʷֱ�Ϊ����v(X)��3.5mol/(L?min)����v(Y)��2mol/(L?min)����v(Z)=4.5mol/(L?min)����v(X)��0.075mol/(L?s)��������������ͬ,�¶Ȳ�ͬ�����¶��ɸߵ��͵�˳����(�����) ��
��3������ﵽ(1)��ƽ����ϵ�г������,��ƽ���� (��"��"��"��"��"��")�ƶ�������
�ﵽ(1)��ƽ����ϵ�����߲��ֻ������,��ƽ���� (��" �� " �� " �� " �� " ��")�ƶ���
��4��������ͬ��������ﵽ(1)������ƽ����ϵ���ٳ���0.5molX����,��ƽ���X��ת���ʢ���ŵ�
ƽ���е�X��ת������Ƚ� ��
| A����ȷ�� | B����һ�����ڢ� | C����һ�����ڢ� | D����һ��С�ڢ� |
��(1)��ƽ���Ч,��a��b��cӦ������Ĺ�ϵΪ ��
��6���������¶Ⱥ�������䣬��ʼʱ����X��Y��Z���ʵ����ֱ�Ϊamol��bmol��cmol,�ﵽƽ��ʱ��
��(1)��ƽ���Ч,����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ�������,��c��ȡֵ��ΧӦ��Ϊ ��
����12�֣���1��0.03mol/(L?min) ��2���� �� �� �� �����ϸ�2�֣�
��3���� ���� ����1�֣� ��4��D ��5��c��3b a��0 ��6��0.9��c��4.5 �����ϸ�2�֣�
���������������1�� 2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
��ʼ����mol�� 3 0 0
ת������mol�� 2x x 3x
ƽ������mol��3��2x x 3x
ƽ��ʱ��������ڵ�ѹǿΪ��ʼʱ��1.2��
�� ��1.2
��1.2
���x��0.3mol
����ƽ��ʱY�����ʵ���Ũ�ȣ�0.3mol��2L��0.15mol/L
���Y�����ʵ���Ũ�ȱ仯��ʾ������Ϊ0.15mol/L��5min��0.03 mol/(L?min)
��2����ͬһ��ʱ���ڲ�������ڵķ�Ӧ���ʷֱ�Ϊ����v(X)��3.5mol/(L?min)����v(Y)��2mol/(L?min)����v(Z)=4.5mol/(L?min)����v(X)��0.075mol/(L?s)������ݷ�Ӧ����֮������Ӧ�Ļ�ѧ������֮�ȿ�֪���������X��ʾ��Ӧ���ʣ���ֱ���3.5mol/(L?min)��4mol/(L?min)��3.0mol/(L?min)��4.5mol/(L?min)���¶�Խ�߷�Ӧ����Խ�����Ը��ݷ�Ӧ���ʿ�֪���¶��ɸߵ��͵�˳����(�����)�����ң��ף�����
��3������ﵽ(1)��ƽ����ϵ�г�������������������ʵ�Ũ�Ȳ��䣬��ƽ�ⲻ�ƶ�������ﵽ(1)��ƽ����ϵ�����߲��ֻ�����壬����������Ũ�Ƚ��ͣ���ƽ�������ƶ���
��4�����ڸ÷�Ӧ���������Ŀ��淴Ӧ���ҷ�Ӧ��ֻ��һ�֣�����ƽ����ٴ�ͨ��X���壬�൱������ѹǿ��ƽ�����淴Ӧ�����ƶ�������������ͬ��������ﵽ(1)������ƽ����ϵ���ٳ���0.5molX���壬��ƽ���X��ת���ʢ���ŵ�ƽ���е�X��ת������ȽϢ�һ��С�ڢţ���ѡD��
��5���������¶Ⱥ�ѹǿ����,��ʼʱ����X��Y��Z���ʵ����ֱ�Ϊamol��bmol��cmol���ﵽƽ��ʱ��
��(1)��ƽ���Ч,����ݷ���ʽ��������Y��Zǡ�ÿ�����ȫת��ΪX���ɣ�����a��b��cӦ������Ĺ�ϵΪc��3b��a��0��
��6���������¶Ⱥ�������䣬��ʼʱ����X��Y��Z���ʵ����ֱ�Ϊamol��bmol��cmol,�ﵽƽ��ʱ��
��(1)��ƽ���Ч������ݷ���ʽ��������Y��Zǡ�ÿ�����ȫת��ΪX��ʹX�����ʵ�������3mol���ɣ�����c�����ֵ��4.5mol������ƽ��ʱc�����ʵ�����0.9mol������Ҫ������ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ�������,��c�������0.9mol�����c��ȡֵ��Χ��0.9��c��4.5��
���㣺������淴Ӧ���й��жϡ����㣻���������ƽ��״̬��Ӱ�죻��Чƽ���Ӧ��������

 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�ijѧ��Ϊ��̽��п�����ᷴӦ���������ʱ仯����100mLϡ�����м���������п�ۣ���״���²�������ۼ�ֵ���£�
| ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
| ���������mL�� | 50 | 120 | 232 | 290 | 310 |
��1����0��1��1��2��2��3��3��4��4��5 minʱ����У���Ӧ��������ʱ����� ��
ԭ��Ϊ ����Ӧ������С��ʱ����� ��
ԭ��Ϊ ����2����2��3minʱ����ڣ��������Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ ��
��3��Ϊ�˼�����Ӧ���ʵ������ٲ��������������������зֱ����������������Һ��A .����ˮ B .Na2SO4��Һ C. NaNO3��Һ D. CuSO4��Һ E. Na2CO3 ��Һ, ����Ϊ���е��� ��
�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2O Ϊԭ�ϣ�ͨ����ӦI�͢����Ʊ��״���
�Ž�1.0 mol CH4��2.0 mol H2O(g)ͨ�˷�Ӧ��(�ݻ�Ϊ100L)����һ�������·�����Ӧ:
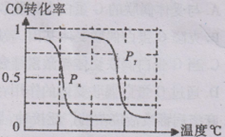
CH4(g)��H2O(g) CO(g)��3H2(g)����I��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CO(g)��3H2(g)����I��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ ��
��ͼ�е�P1_ P2(�<������>����=��),100��ʱƽ�ⳣ��Ϊ ��
�۸÷�Ӧ�ġ�H 0(�<������>����=��)��
(2)��һ�������£���a mol CO��3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״�: CO(g)+2H2(g) CH3OH(g) ��H<0 ������
CH3OH(g) ��H<0 ������
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���lmol CO��3 mol H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
A���±���ʣ���ʵ����������: a=_ ��b=_ ��
| ʵ���� | T���棩 | n(CO)��n(H2) | P(Mpa) |
| 1 | 150 | 1��3 | 0.1 |
| 2 | a | 1��3 | 5 |
| 3 | 350 | b | 5 |
 CH3OCH3(g)��CO2(g) ��H<0
CH3OCH3(g)��CO2(g) ��H<0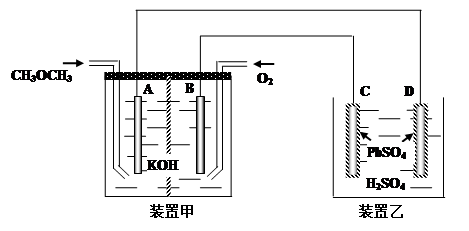
 pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С���� 2SO3����д���пհף�
2SO3����д���пհף�
 Cr2O72-(��ɫ)+H2O
Cr2O72-(��ɫ)+H2O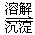 Cr3+(aq)+3OH��(aq)
Cr3+(aq)+3OH��(aq)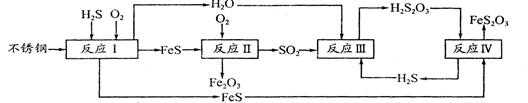
 H2S(g) ��H=��21��6kJ��mol��1����Ӧ�ﵽƽ��ʱH2��S��H2S�����ʵ�����Ϊ3 mol����380 Kʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______�����жԸ÷�Ӧ������ȷ����______(����ĸ���)��
H2S(g) ��H=��21��6kJ��mol��1����Ӧ�ﵽƽ��ʱH2��S��H2S�����ʵ�����Ϊ3 mol����380 Kʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______�����жԸ÷�Ӧ������ȷ����______(����ĸ���)��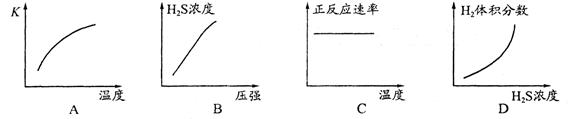
 H2(g) +CO2(g)ƽ�ⳣ��K���¶ȵı仯���±���
H2(g) +CO2(g)ƽ�ⳣ��K���¶ȵı仯���±���
 2C0 Cg)ƽ�ⳣ��K1��
2C0 Cg)ƽ�ⳣ��K1�� CO Cg) +H2(g)ƽ�ⳣ��K2
CO Cg) +H2(g)ƽ�ⳣ��K2
