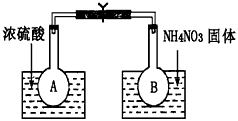
题目内容
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,其反应为:3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g) ΔH<0
CH3OCH3(g)+CO2(g) ΔH<0
(1)在一定条件下的密闭容器中,该反应达到平衡后,只改变一个条件能同时提高反应速率和CO的转化率的是________(填字母代号,下同)。
a.降低温度 b.加入催化剂
c.缩小容器体积 d.减少CO2的浓度
(2)若反应在体积恒定的密闭容器中进行,下列能判断反应已达平衡状态的是________
a.3V正(CO2)=V逆(CO) b.生成a mol CO2的同时消耗3a mol H2
c.气体的密度不再改变 d.混合气体的平均相对分子质量不变
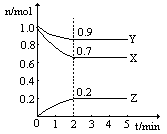
(3)300℃时,在体积为2L的容器中充入4 mol H2、6 mol CO。5min时,反应恰好达平衡,此时H2的转化率为75%。
① 5min时V(CO)=_________mol/(L·min)。该温度下,此反应的平衡常数为:_______
② 保持温度不变,在以上已达反应平衡的容器中,将每种物质同时增加1mol,则此时平衡将_______移动(填“正向”、“逆向”、“不”)
(4).下图中,甲装置为CH3OCH3、O2、KOH三者构成的燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
① 写出甲装置中A极的电极反应式___________________________________________
② 写出乙装置中C极的电极反应式___________________________________________
③ 当有23克甲醚参加反应时,D电极的质量变化为______克。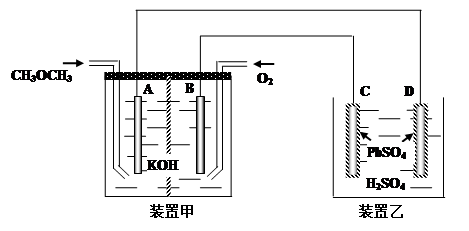
(1)c (2分)
(2)a d (2分) 只选a或d(1分)
(3)①.0.3 (2分); 16/27 (2分); ②.正向(2分)
(4)①.CH3OCH3+16OH--12e-=2CO32-+11H2O (2分)
②.PbSO4+2H2O-2e-=PbO2+4H++SO42-(2分)
③.288 (2分)
解析试题分析:(1)a、降低了反应速率,错误;b、CO的转化率不变,错误;c、正确;d、反应速率先不变后 减少,错误;
(2)a、正反应速率等于你反应速率时达到化学平衡,正确;b、恒等,不管是否达到平衡,错 误;c、因为体积不变,质量不变,所以密度恒定不变,不管是否达到平衡,错误;d、正 确。
(3)①4*75%/2/5=0.3,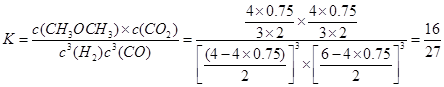
②压强增大,平衡向体积减少的方向移动,即平衡正向移动;
(4)①Pb丝为惰性电极,不参与电极反应,在甲醚燃烧反应中,甲醚中碳元素的化合价升高,被氧化,氧气中氧元素的化合价降低,被还原。在原电池中,负极发生氧化反应,正极发生还原反应,说明通入甲醚的那一极是负极,通入氧气的那一极是正极。甲醚在负极发生氧化反应,氧气在正极发生还原反应。负极(Pb丝),碳的化合价升高到+4价,在KOH溶液中以碳酸根离子的形式存在,所以电极反应为: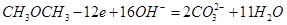 ;
;
②与正极相连的是阳极,Pb在阳极失去电子由+2价氧化为+4价;
③D是硫酸钡被还原为钡单质,所以D电极的质量减少量= 。
。
考点:燃料电池。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案甲醇被称为2l世纪的新型燃料,工业上通过下列反应I和II,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) 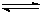 CO(g)+3H2 (g)……I CO(g)+2H2(g)
CO(g)+3H2 (g)……I CO(g)+2H2(g) 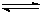 CH3OH(g) ……II。
CH3OH(g) ……II。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。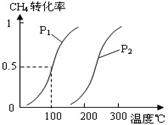
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为____________________。
②图中的P1_________P2(填“<”、“>”或“=”),100℃时平衡常数的值为__________ 。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H ____ 0;若容器容积不变,下列措施可增加甲醇产率的是________。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
| 实验编号 | T(℃) | N(CO)/n(H2) | P(Mpa) |
| i | 150 | 1/3 | 0.1 |
| ii | | | 5 |
| iii | 350 | | 5 |
a.请在上表空格中填入剩余的实验条件数据。
b.根据反应II的特点,在给出的坐标图中,画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。
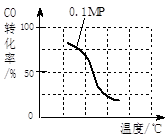
Ⅰ. 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O  2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液后,溶液呈 色,因为 。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,则溶液呈 色,因为 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡向 方向移动,溶液颜色将 。(填“变深”、“变浅”或“不变”)
Ⅱ.实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
1.配制100mL 0.10mol/L NaOH标准溶液。
2.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
3.重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |
(1)滴定达到终点的现象是 ,此时锥形瓶内溶液的pH范围为 。
(2)根据上述数据,可计算出该盐酸的浓度约为 。
(3)排去碱式滴定管中气泡的方法应采用下图 的操作,然后挤压玻璃球使尖嘴部分充满碱液。



甲 乙 丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有 (多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件, 能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅, 其反应如下: 3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)在一定温度下进行上述反应, 若反应容器的容积为2 L, 3 min后达到平衡, 测得固体质量增加了2. 80 g, 则转移电子的物质的量为 ,H2的平均反应速率为 mol/(L·min); 该反应的平衡常数表达式K= 。
(2)上述反应达到平衡后, 下列说法正确的是 。
a. 其他条件不变, 压强增大, 平衡常数K减小
b. 其他条件不变, 温度升高, 平衡常数K减小
c. 其他条件不变, 增大Si3N4物质的量,平衡向左移动
d. 其他条件不变, 增大HCl物质的量,平衡向左移动
(3)一定条件下, 在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是 。
| A.3v逆(N2)=v正(H2) | B.v正(HCl)=4v正(SiCl4) |
| C.混合气体密度保持不变 | D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6 |
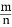 , 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比
, 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比 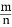 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。 研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g)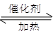 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
| 反应时间/min | n(NO2)/mol | n(NH3)/ mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.90 | |
| 4 | | 0.40 |
(2)700℃ ,将NO2与NH3以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.体系密度保持不变
d.每消耗1 mol NO2的同时生成2 mol H2O
(12分)向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为 。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3.5mol/(L?min);乙v(Y)=2mol/(L?min);丙v(Z)=4.5mol/(L?min);丁v(X)=0.075mol/(L?s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) 。
(3)若向达到(1)的平衡体系中充入氩气,则平衡向 (填"左"或"右"或"不")移动;若向
达到(1)的平衡体系中移走部分混合气体,则平衡向 (填" 左 " 或 " 右 " 或 " 不")移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的
平衡中的X的转化率相比较 。
| A.无法确定 | B.⑷一定大于⑴ | C.⑷一定等于⑴ | D.⑷一定小于⑴ |
与(1)的平衡等效,则a、b、c应该满足的关系为 。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍
与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为 。
 。
。 Cr2O72—(橙色)+H2O。
Cr2O72—(橙色)+H2O。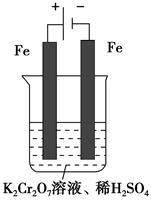
 N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: