题目内容
15.各组性质比较的表示中,正确的是( )| A. | 沸点:Cl2<2<Br2<I2 | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 氧化性:F2<Cl2<Br2<I2 | D. | 还原性:HF<HCl<HBr<HI |
分析 A.卤族元素单质中,单质的熔沸点随着相对分子质量增大而增大;
B.氢化物的分子量越大沸点越高,分子间存在氢键的沸点最高;
C.元素的非金属性越强,其单质的氧化性越强;
D.元素的非金属性越强,其简单阴离子的还原性越弱,对应氢化物的还原性越弱.
解答 解:A、卤族元素单质中,单质的熔沸点随着相对分子质量增大而增大,相对分子质量F2<Cl2<Br2<I2,所以熔沸点F2<Cl2<Br2<I2,故A错误;
B.氢化物的分子量越大沸点越高,但是HF分子间存在氢键,所以沸点最高,即沸点顺序是HCl<HBr<HI<HF,故B错误;
C、元素的非金属性越强,其单质的氧化性越强,非金属性F>Cl>Br>I,所以氧化性:F2>Cl2>Br2>I2,故C错误;
D、元素的非金属性越强,其简单阴离子的还原性越弱,对应氢化物的还原性越弱,非金属性F>Cl>Br>I,所以还原性:HF<HCl<HBr<HI,故D正确;
故选D.
点评 本题考查同一主族元素性质递变规律,为高考高频点,明确非金属性强弱与氢化物的稳定性、沸点高低、最高价氧化物的水化物酸性、单质的氧化性、简单阴离子的还原性关系,熟练掌握碱金属族、卤族元素性质递变规律,题目难度不大.

练习册系列答案
相关题目
8.CoCl2•6H2O是一种饲料营养强化剂.以含钴单质废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
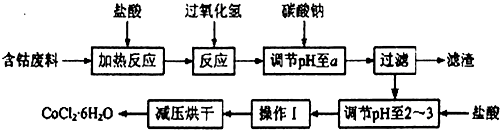
已知:
①CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑.
(2)流程中加入碳酸钠调节pH至a,a的范围是5.2~7.6;滤渣中含有的Al(OH)3是良好的阻燃剂,其原理是Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的Al2O3覆盖在可燃物表面,阻燃效果更佳;加盐酸调节pH至2~3的目的是抑制Co2+的水解,防止在后续的操作中形成Co(OH)2杂质.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将119g样品溶于水形成100ml溶液,取25mL于烧杯中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称得质量为28.7g,计算产品中CoCl2•6H2O含量为80%.(已知:CoCl2•6H2O化学式量为238,AgCl为143.5,)

已知:
①CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑.
(2)流程中加入碳酸钠调节pH至a,a的范围是5.2~7.6;滤渣中含有的Al(OH)3是良好的阻燃剂,其原理是Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的Al2O3覆盖在可燃物表面,阻燃效果更佳;加盐酸调节pH至2~3的目的是抑制Co2+的水解,防止在后续的操作中形成Co(OH)2杂质.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将119g样品溶于水形成100ml溶液,取25mL于烧杯中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称得质量为28.7g,计算产品中CoCl2•6H2O含量为80%.(已知:CoCl2•6H2O化学式量为238,AgCl为143.5,)
9.下列各组离子,在指定的环境中能够大量共存的是( )
| A. | 有Fe3+大量存在的溶液中:Na+、Cl-、K+、SCN- | |
| B. | 滴加酚酞显红色的溶液中:NH4+、Al3+、SO42-、NO3- | |
| C. | 常温下pH=1的溶液中:Na+、K+、Cl-、S2O32- | |
| D. | 有CO32-存在的无色透明溶液中:Na+、K+、Cl-、AlO2- |
3.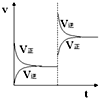 在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
 在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )| A. | 正反应是吸热反应 | B. | 逆反应是吸热反应 | ||
| C. | m+n>p+q | D. | m+n<p+q |
10.亚硝酸溶液中离子和分子同时存在则亚硝酸是( )
| A. | 弱电解质 | B. | 强电解质 | C. | 非电解质 | D. | 混合物 |
4.科学家刚刚发现了某种元素的原子,其质量是ag,12C的原子质量是bg,NA是阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 该原子的摩尔质量是aNAg/mol | |
| B. | Wg该原子的物质的量一定是$\frac{W}{{a{N_A}}}$mol | |
| C. | Wg该原子中含有$\frac{w}{a}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{b}{12}$ |