题目内容
16.设NA为阿伏加德罗常数,下列说法中错误的是( )| A. | 含1molFeCl3 的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 12克金属镁与足量的盐酸反应,转移电子数一定为NA(已知:Mg-2e-═Mg2+) | |
| C. | 10.6克Na2CO3晶体中含Na+数目为0.2NA | |
| D. | 常温常压下,22克CO2和0.5NA个CH4分子的体积是相等的 |
分析 A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
B、求出镁的物质的量,然后根据反应后镁变为+2价来分析;
C、求出碳酸钠的物质的量,然后根据1mol碳酸钠中含2mol钠离子来分析;
D、同温同压下,相同物质的量的气体具有相同的体积.
解答 解:A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于NA个,故A错误;
B、12g镁的物质的量为0.5mol,而反应后镁变为+2价,故0.5mol镁失去1mol电子即NA个,故B正确;
C、10.6g碳酸钠的物质的量为0.1mol,而1mol碳酸钠中含2mol钠离子,故0.1mol碳酸钠中含0.2mol钠离子即0.2NA个,故C正确;
D、22g二氧化碳的物质的量为0.5molmol,0.5NA个甲烷分子的物质的量也为0.5mol,而同温同压下,相同物质的量的气体具有相同的体积,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.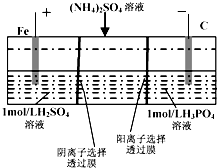 用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
 用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 电解一段时间后,阴极室溶液中的pH升高 | |
| C. | 阴极的电极反应式为:4OH--4e-═2H2O+O2↑ | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
7.下列有关物质性质和应用都正确的是( )
| A. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| B. | 明矾净水是因为Al(OH)3胶体能消毒 | |
| C. | MgO、Al2O3熔点高,它们都可用于制作耐火材料 | |
| D. | 高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
4.氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗.纯化工业级氧化锌[含
有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业ZnO$→_{①}^{稀H_{2}SO_{4}}$ 浸出液$→_{适量高锰酸钾溶液②}^{调pH约为5}$ $\stackrel{过滤}{→}$ 滤液$→_{③}^{Zn}$ $\stackrel{过滤}{→}$滤液 $→_{④}^{Na_{2}CO_{3}}$ 滤饼$→_{⑤}^{煅烧⑤}$ZnO
已知:a.在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2;
b.Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
回答下列问题:
(1)反应②中除掉的杂质离子是Fe2+、Mn2+,发生反应的离子方程式为MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;在加高锰酸钾溶液之前,若pH较低,对除杂的影响是铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
(2)反应③的反应类型为置换反应(填“化合反应”、“分解反应”、“置换反应”或“复分解反应”),过滤得到的滤渣中,除了过量的锌外还有镍;
(3)反应④形成的沉淀要用水洗,检验沉淀已洗涤干净的方法是取最后一次少量水洗液于试管中,滴入1~2滴稀盐酸,再滴入氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净.
(4)反应④中产物的成分可能是ZnCO3•xZn(OH)2,取干燥后的滤饼22.4g,煅烧后可得到产品16.2g.则x等于1.
有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业ZnO$→_{①}^{稀H_{2}SO_{4}}$ 浸出液$→_{适量高锰酸钾溶液②}^{调pH约为5}$ $\stackrel{过滤}{→}$ 滤液$→_{③}^{Zn}$ $\stackrel{过滤}{→}$滤液 $→_{④}^{Na_{2}CO_{3}}$ 滤饼$→_{⑤}^{煅烧⑤}$ZnO
已知:a.在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2;
b.Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ | Fe2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 |
(1)反应②中除掉的杂质离子是Fe2+、Mn2+,发生反应的离子方程式为MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;在加高锰酸钾溶液之前,若pH较低,对除杂的影响是铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
(2)反应③的反应类型为置换反应(填“化合反应”、“分解反应”、“置换反应”或“复分解反应”),过滤得到的滤渣中,除了过量的锌外还有镍;
(3)反应④形成的沉淀要用水洗,检验沉淀已洗涤干净的方法是取最后一次少量水洗液于试管中,滴入1~2滴稀盐酸,再滴入氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净.
(4)反应④中产物的成分可能是ZnCO3•xZn(OH)2,取干燥后的滤饼22.4g,煅烧后可得到产品16.2g.则x等于1.
1.下列各组离子在满足指定条件下,能大量共存的是( )
| A. | 无色溶液:Cu2+、K+、Cl-、CO${\;}_{3}^{2-}$ | |
| B. | 使酚酞显红色的溶液:Mg2+、Fe2+、Cl-、SO${\;}_{4}^{2-}$ | |
| C. | 加Fe粉能产生H2的溶液:Ba2+、Na+、Cl-、SO${\;}_{4}^{2-}$ | |
| D. | 加盐酸能产生气体的溶液:Na+、K+、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ |
8.下列说法正确的是( )
| A. | 原子最外层电子数大于3的元素一定是非金属元素 | |
| B. | 碱金属单质的密度随原子序数的增大而依次增大 | |
| C. | 一个氕原子实际上就是一个质子 | |
| D. | 某元素形成的离子为${\;}_{a}^{b}$Xn-,则1个X原子的质量约为$\frac{b}{6.02×1{0}^{23}}$g |
5.下列溶液中,物质的量浓度最大的是( )
| A. | 1LH2SO4溶液中含98gH2SO4 | B. | 0.5L含49gH2SO4的溶液 | ||
| C. | 98gH2SO4溶于水配成2 L溶液 | D. | 1L含196gH2SO4的溶液 |
6.下列各组中的离子,在溶液中能大量共存的是( )
| A. | Ag+、H+、Cl-、CO32- | B. | H+、Ba2+、OH-、SO42- | ||
| C. | Ba2+、K+、Cl-、NO3- | D. | Ca2+、HCO3-、Cl-、OH- |