题目内容
在20mL0.1mol/L 的醋酸溶液中,能使溶液的pH减小,而且使醋酸的电离平衡向逆方向移动,可加入的试剂是
| A.20mL水 | B.浓盐酸 | C.冰醋酸 | D.NaOH溶液 |
B
解析试题分析:醋酸电离方程式为:CH3COOH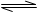 CH3COO-+H+,若使溶液PH降低,且平衡像逆反应方向移动。A选项错误,加水后PH增大,稀释溶液平衡向正反应方向移动。B选项正确。加入浓盐酸后
CH3COO-+H+,若使溶液PH降低,且平衡像逆反应方向移动。A选项错误,加水后PH增大,稀释溶液平衡向正反应方向移动。B选项正确。加入浓盐酸后
PH降低,H+浓度增大,平衡向逆反应方向移动。C选项,加入冰醋酸,PH减小,但平衡向正反应方
向移动。D选项错误,加入氢氧化钠溶液,PH值增大,平衡向正反映方向移动。
考点:弱电解质电离平衡

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时,已知数据如表所示:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
A.向该混合溶液中加入少量铁粉即能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀
C.该混合溶液中c(SO42-)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
D.向该混合溶液中加入适量氨水,并调节pH为3~4,然后过滤,可得到纯净的CuSO4溶液
HA为酸性略强于醋酸的一元弱酸.在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
| A.c(Na+)>c(A-)>c(H+)>c(OH-) | B.c(Na+)>c(OH-)>c(A-)>c(H+) |
| C.c(Na+)+c(OH-)=c(A-)+c(H+) | D.c(Na+)+c(H+)=c(A-)+c(OH-) |
25 ℃时,在PbI2饱和溶液中,存在着平衡PbI2(s) Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是
Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是
| A.溶液中Pb2+和I-浓度都增大 | B.溶度积常数Ksp不变 |
| C.沉淀溶解平衡不移动 | D.溶液中Pb2+和I-浓度不变 |
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
| A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO和OH- |
| B.NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-) |
| C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
下列溶液肯定呈酸性的是( )
| A.含有H+离子的溶液 | B.c(OH-)=1×10-8mol/L的溶液 |
| C.c(OH-)<c(H+)的溶液 | D.pH小于7的溶液 |