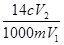题目内容
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl)<c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]
B.已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH约为1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2->c(H2A)
AC
解析试题分析:A、(NH4)2SO4溶液中硫酸根离子对铵根离子水解无影响,(NH4)2Fe(SO4)2和溶液中亚铁离子水解显酸性抑制铵根离子的水解,NH4Cl溶液中氯离子对铵根离子无影响,当铵根离子浓度相同时溶质浓度应为,c(NH4Cl)>c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2],故A错误;B、依据一定温度下沉淀溶解平衡中存在溶度积常数,依据溶度积和沉淀溶解平衡,计算银离子最大浓度;Ksp(AgCl)=1.8×10-10,0.1mol?L-1AlCl3溶液中c(Cl-)为0.3mol/L,Ksp(AgCl)=c(Ag+)×c(Cl-)=C(Ag+)×0.3mol/L=1.8×10-10 ,解得c(Ag+)=6×10-10mol/L;故B正确;C、0.2mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,依据溶液中溶质物质的量分析判断,酸过量。设酸、碱溶液体积为1L,盐酸溶液中氢离子物质的量为0.2mol,氢氧化钡溶液中氢氧根离子物质的量为0.1mol,所以混合溶液中c(H+)=(0.2mol-0.1mol)÷2L=0.05mol/L,溶液的pH=-lg0.05=2-lg5,故C错误;D、0.1mol?L-1NaHA溶液的pH=4,溶液呈酸性,说明酸式酸根离子的电离程度大于水解程度,溶液中的离子浓度大小顺序为c(Na+)>c(HA-)>c(H+)C>c(A2-)C>c(H2A);故D正确,答案选AC。
考点:考查盐类水解、溶液中离子浓度大小比较

 阅读快车系列答案
阅读快车系列答案下列说法中,正确的是
| A.强电解质的水溶液一定比弱电解质的水溶液的导电能力强 |
| B.强电解质都是离子化合物,弱电解质都是共价化合物 |
| C.强电解质的水溶液中不存在溶质分子 |
| D.不溶性盐都是弱电解质,可溶性酸和具有极性键的化合物都是强电解质 |
在20mL0.1mol/L 的醋酸溶液中,能使溶液的pH减小,而且使醋酸的电离平衡向逆方向移动,可加入的试剂是
| A.20mL水 | B.浓盐酸 | C.冰醋酸 | D.NaOH溶液 |
0.1mol·L-1Na2S溶液,下列关系正确的是
| A.c(Na+)=2c(S2-) |
| B.c(OH-)="c" (H+)+c (HS-)+2c (H2S) |
| C.c(Na+) >c(S2-) >c (HS-) >c (OH-) |
| D.c(Na+)+c (H+)="2c" (S2-)+c (HS-)+c (OH-) |
在RNH2·H2O RNH3++OH-的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
RNH3++OH-的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
| A.通入HCl | B.加少量NaOH固体 | C.加水 | D.升温 |
25℃时,水的电离达到平衡:H2O H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱 |
| D.将水加热,KW增大,pH不变 |
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH4+)>c(SO42-)>c(Fe2+)>c(H+) |
| B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-) |
| D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
25℃时对于pH=1的盐酸,下列叙述不正确的是
| A.c(H+)= c(Cl—)+ c(OH—) |
| B.c(H+)·c(OH—)=1.0×10—14 |
| C.由水电离出的c(H+)=1.0×10—13mol?L—1 |
| D.与pH=13的NaOH溶液混合后,混合溶液一定呈中性 |