题目内容
常温下,0.1mol·L-1CH3COONa溶液中,微粒浓度间关系正确的是
| A.c(Na+)=c(CH3COO-) >c(OH-)=c(H+) |
| B.c(OH-)=c(H+)+ c(CH3COOH) |
| C.c(Na+) + c(H+)= c(CH3COO-) +c(OH-) |
| D.c(CH3COOH) + c(CH3COO-) = c(Na+)+ c(H+) |
BC
解析试题分析:A项由于CH3COO-发生水解使溶液显碱性,错误;B项满足CH3COONa溶液的质子守恒,正确;C项满足CH3COONa溶液的电荷守恒,正确;D项不满足CH3COONa溶液的物料守恒,错误。
考点:考查电解质溶液中的三大守恒及微粒浓度大小关系。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(15分) 某同学设计了如下图所示装置(部分夹持装置已略去),该装置可以用来进行多项
实验研究。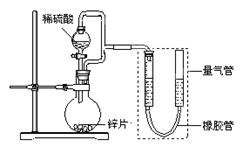
请回答:
(1)用上述装置探究影响化学反应速率的因素。
①圆底烧瓶中发生反应的离子方程式是 。
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为t1>t2。
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
比较实验Ⅰ和Ⅱ可以得出的实验结论是 。
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号) 。
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置测定粗锌片的纯度。
①连接好装置,检查装置气密性,称量粗锌片mg置于圆底烧瓶中,滴加足量稀硫酸,充分反应直至不再产生气体为止,测得气体体积为VL,则粗锌片的纯度为 。
②本实验在读数前对量气管的操作是 。
③本套装置中若考虑滴入的稀硫酸的体积(假设其它操作都正确),则测得的气体的体积将 。(填“偏大”、“偏小”或“无影响”,)
(3)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用(填序号) 。
a.NH4Cl溶液 b.C2H5OH c.Na2CO3溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 。
下列物质属于弱电解质的是
| A.HNO3 | B.NaOH | C.KCl | D.CH3COOH |
下列各溶液中,相关微粒物质的量浓度关系不正确的是
| A.0.1 mol·L-1NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| B.0.1 mol·L-1NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1 mol·L-1 |
| C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| D.常温下,浓度为0.1 mol·L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)> c(H+) |
下列说法正确的是
| A.常温下,某溶液中由水电离出的c(H+)=1×10-amo1·L–1,若a<7时,则该溶液可能为NaHSO4溶液 |
| B.常温下,中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸)=V(醋酸) |
| C.25℃时,已知Ka(CH3COOH)=1.7×10-5mo1·L–1、Ka(C6H5OH) =1.0×10-10mo1·L–1、 Ka1(H2CO3) = 4.2×10-7mo1·L–1 、Ka2(H2CO3) =5.6×10-11mo1·L–1pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:②<③<① |
| D.常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸有气泡产生,说明常温下Ksp(BaSO4)>Ksp(BaCO3) |
为了除去MgCl2酸性溶液中的 Fe3+,可在加热搅拌条件下加入一种试剂,过滤后,在向滤液中加入适量的盐酸,这种试剂是
| A.NaOH | B.NH3·H2O | C.MgCl2 | D.MgCO3 |
常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是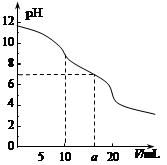
| A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-) |
| B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-) |
| C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3)[来源:学*科*网] |
| D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
| A.HCN易溶于水 |
| B.HCN溶液能导电 |
| C.1mol/L氢氰酸溶液的pH约为3 |
| D.10 mL1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应 |
下列有关说法正确的是
| A.常温下,0.1 mol·L-1 CH3COOH溶液的pH=1 |
| B.铅蓄电池在放电过程中,负极质量增加,正极pH减少 |
| C.反应CO2(g)+C(s)=2CO(g)在低温下不能自发进行,则其△H>0 |
| D.常温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小 |