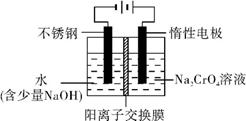
��Ŀ����
(15��) ijͬѧ���������ͼ��ʾװ�ã����ּг�װ������ȥ������װ�ÿ����������ж���
ʵ���о���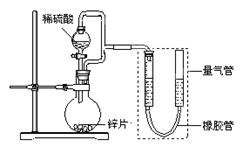
��ش�
��1��������װ��̽��Ӱ�컯ѧ��Ӧ���ʵ����ء�
��Բ����ƿ�з�����Ӧ�����ӷ���ʽ�� ��
��������װ�ý���ʵ�飬������9.0 mL����Ϊ��ʱ�յ㣬���Ϊt1��t2��
| ��� | V(H2SO4)/mL | c(H2SO4)/mol��L��1 | t/s |
| �� | 40 | 1 | t1 |
| �� | 40 | 4 | t2 |
�Ƚ�ʵ���͢���Եó���ʵ������� ��
������пƬ���ɺ����ʵĴ�пƬ���ҿ�����������ʹ��������ʵ����ȫһ�£�����õķ�Ӧ���ʾ���������ʵ���Ӧ�����ݡ���пƬ���������ʿ����ǣ�����ţ� ��
a��ʯī b���� c��ͭ d��ɳ�����������裩
��2��������װ�òⶨ��пƬ�Ĵ��ȡ�
�����Ӻ�װ�ã����װ�������ԣ�������пƬmg����Բ����ƿ�У��μ�����ϡ���ᣬ��ַ�Ӧֱ�����ٲ�������Ϊֹ������������ΪVL�����пƬ�Ĵ���Ϊ ��
�ڱ�ʵ���ڶ���ǰ�������ܵIJ����� ��
�۱���װ���������ǵ����ϡ��������������������������ȷ�������õ����������� �����ƫ����ƫС������Ӱ�족����
��3��������װ����֤�����ڳ�ʪ�����лᷢ��������ʴ��
��Բ����ƿ�е��Լ���ѡ�ã�����ţ� ��
a��NH4Cl��Һ b��C2H5OH c��Na2CO3��Һ d��ϡ����
����֤�������ڳ�ʪ�����лᷢ��������ʴ�������� ��
��15�֣���1����Zn+2H+ ��Zn2++H2����1�֣�
������������һ��ʱ����ѧ��Ӧ�����淴Ӧ��Ũ�ȵ����������2�֣���abc��2�֣�
��2���� ��100%��2�֣�
��100%��2�֣�
�ڴ�������ȴ�����ұ������ܸ߶ȣ�ʹ�����ҹ���ˮ����ƽ��2�֣� ����Ӱ�죨2�֣�
��3����c ��2�֣� ����������ܵ�ˮ���������ҹܵ�ˮ���½���2�֣�
���������������1����п��ϡ���ᷴӦ�����ӷ���ʽΪZn+2H+ ��Zn2++H2����
�ڸ��ݱ������ݿ�֪��ʵ���͢���ȣ�ʵ����������Ũ�ȴ���ʱ�٣���˵������������һ��ʱ����ѧ��Ӧ�����淴Ӧ��Ũ�ȵ����������
������õķ�Ӧ���ʾ���������ʵ���Ӧ�����ݣ���˵����пƬ������������п������ԭ��أ������ʵĽ���������п�ģ����Է�����������ʯī������ͭ����ѡabc��
��2��������������ڱ�״������VL�������������ʵ����� mol������ݷ���ʽ��֪���μӷ�Ӧ��п�����ʵ�����
mol������ݷ���ʽ��֪���μӷ�Ӧ��п�����ʵ����� mol����������
mol���������� mol��65g/mol��
mol��65g/mol��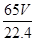 g�����Դ�пƬ�Ĵ���Ϊ
g�����Դ�пƬ�Ĵ���Ϊ ��100%��
��100%��
�����������������¶Ⱥ�ѹǿӰ��������ڶ���ǰ�������ܵIJ����Ǵ�������ȴ�����ұ������ܸ߶ȣ�ʹ�����ҹ���ˮ����ƽ��
������װ���Ƿ�յģ�����ϡ��������������Ӱ����������ܵ������������˶�ʵ������Ӱ�졣
��3����Ҫ������װ����֤�����ڳ�ʪ�����лᷢ��������ʴ����������Һ������Ӧ�ú��������������Ի���ԡ��Ȼ������ˮ�����ԣ�ϡ��������ˮ�����ԣ��Ҵ��Ƿǵ���ʣ�̼������Һ�Լ��ԣ����Դ�ѡc��
���������������ʴ����װ����ѹǿ���ͣ�������֤�������ڳ�ʪ�����лᷢ��������ʴ����������������ܵ�ˮ���������ҹܵ�ˮ���½���
���㣺������������Է�Ӧ���ʵ�Ӱ�졢���Ȳⶨ����������ⶨ��������������ʴ�Լ�ʵ�鷽����������۵�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д���ҵ������Ϊԭ��(����Ͻ���Ϊ����)��������������Ĺ������£�
|

 ��1����֪��Ӧһ������������Ͻ����ͻᴦ�ں���״̬��д�����������Ļ�ѧ����ʽ��______________________________________________�����¶�����ʱ���÷�Ӧ��ƽ�ⳣ��Kֵ___________(���������С�����䡱)��
��1����֪��Ӧһ������������Ͻ����ͻᴦ�ں���״̬��д�����������Ļ�ѧ����ʽ��______________________________________________�����¶�����ʱ���÷�Ӧ��ƽ�ⳣ��Kֵ___________(���������С�����䡱)����2�����᳧β�����õĴ��������Ǵ���ԭ������������ʱ��H2��NO2��ԭΪN2����֪��
2H2(g)+O2(g)=2H2O(g) ��H= a kJ��mol��1
N2(g)+2O2(g)=2NO2(g) ��H= b kJ��mol��1
H2O(1)=H2O(g) ��H= c kJ��mol��1
��Ӧ2NO2(g)+4H2(g)=N2(g)+4H2O(1)�ġ�H=_________��(��a��b��c��ʾ)
��3���ٺϳɰ���Ӧ�Ļ�ѧ����ʽΪN2+3H2
 2NH3���÷�Ӧ�ڹ̶��ݻ����ܱ������н��С����и����־�Ÿ÷�Ӧ�ﵽ��ѧƽ��״̬����____________(�����)
2NH3���÷�Ӧ�ڹ̶��ݻ����ܱ������н��С����и����־�Ÿ÷�Ӧ�ﵽ��ѧƽ��״̬����____________(�����)A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2
B��3v��(N2)=v��(H2)
C��������ѹǿ���ֲ���
D������������Է����������ֲ���
E��1mol N��N�����ѣ�ͬʱ1mol H��H������
�����ں��������£���N2��H2��һ���������ͨ��һ���ݻ�Ϊ2L���ܱ������У�5min��Ӧ��ƽ�⣬n(N2)=1mol��n(H2)=1mol��n(NH3)=2mol����Ӧ����v(N2)=________________��H2��ƽ��ת����=_________________���������������¶Ȳ��䣬��10minʱ���������ݻ�ѹ��ΪlL�����ڴ������ͼ�У������ӷ�Ӧ��ʼ��15minʱc(NH3)��ʱ��仯����ʾ��ͼ��
Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�PH��Fe2+Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣
��ʵ����ơ�����p-CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±�����������¶Ա����顣
��1�����������ʵ����Ʊ������в�Ҫ���ո�
| ʵ�� ��� | ʵ��Ŀ�� | T/K | pH | c/10-3mol��L-1 | |
| H2O2 | Fe2+ | ||||
| �� | Ϊ����ʵ�����ο� | 298 | 3 | 6.0 | 0.30 |
| �� | ̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� | | | | |
| �� | | 298 | 10 | 6.0 | 0.30 |
�����ݴ�����ʵ����p-CP��Ũ����ʱ��仯�Ĺ�ϵ����ͼ��
��2���������ͼʵ������ߣ����㽵�ⷴӦ��50~150s�ڵķ�Ӧ���ʣ�
�ԣ�p-CP��= mol��L-1��s-1
��3��ʵ��١��ڱ����¶����ߣ����ⷴӦ���������¶ȹ���ʱ�������½��ⷴӦ���ʼ�С�����Fenton�������Լ�H2O2�ĽǶȷ���ԭ��
��
��4��ʵ��۵ó��Ľ����ǣ�pH����10ʱ�� ��
��5��ʵ��ʱ���ڲ�ͬʱ��ӷ�Ӧ����ȡ������ʹ��ȡ��Ʒ�еķ�Ӧ����ֹͣ������������ͼ�е���Ϣ������һ��Ѹ��ֹͣ��Ӧ�ķ��� ��
Ϊ���о���������Թ�������ֽ����ʵ�Ӱ�죬ijͬѧ��������ʵ�飬��ش��������⡣
| ��� | ���� | ʵ������ |
| �� | �ֱ����Թ�A��B�м���5 mL 5% H2O2��Һ��������2��1 mol/L FeCl3��Һ�����Թ��о����������ݳ���ʱ�����Թ�A����ʢ��5��������ˮ���ձ��н��ݣ����Թ�B����ʢ��40��������ˮ���ձ��н��ݡ� | �Թ�A�в��ٲ������ݣ� �Թ�B�в��������������� |
| �� | ��ȡ��֧�Թֱܷ����5 mL 5% H2O2��Һ��5 mL 10% H2O2��Һ | �Թ�A��B�о�δ���Լ��������ݲ����� |
��1����������ֽ�Ļ�ѧ����ʽΪ__________________________________________��
��2��ʵ��ٵ�Ŀ����______________________________________________________��ʵ���еμ�FeCl3��Һ��Ŀ����_________________________________________��
��3��ʵ���δ�۲쵽Ԥ�ڵ�ʵ������Ϊ�˰�����ͬѧ�ﵽʵ��Ŀ�ģ�������Ķ����������ĸĽ������__________________________________����ʵ�������ṩ�ļ����Լ�����
��4��ijͬѧ��50 mLһ��Ũ�ȵ�H2O2��Һ�м���һ�����Ķ������̣��ų�������������״���£��뷴Ӧʱ��Ĺ�ϵ����ͼ��ʾ����A��B��C��������ʾ��˲ʱ��Ӧ������������______________________��

������ʵ(������)����˵��������������ʵ���
| A����������ҺpH>7 |
| B��������Һ���ܽ�̼��� |
| C��0��1mol��L-1������ҺpH=2��9 |
| D��pH=1�Ĵ�����Һϡ��100����pH<3 |
25Cʱ����Ũ��Ϊ0.1000 mol/L��NaOH��Һ�ζ�20. 00 mL 0 .1000 mol��L-1��
CH3COOH.���ζ�������ͼ��ʾ�����з����������
| A��C�����Һ��c��CH3COOһ��+c(CH.3COOH)>c(Na+) |
| B��B�����Һc (CH3COOһ)>c(Na+��>c(H+��> c(OH-) |
| C��A���������ֵΪl |
| D��D����Һ2c(CH3COOH)ʮc(H+) =c(OH��)��c(CH3COO��) |
�����й��������ε�ˮ���ص��ǣ� ��
| A��NH4Cl��ZnCl2��Һ�������ӽ���ʱ�ij���� |
| B����NaHCO3��Al2(SO4)3������Һ���Ƴ���ĭ���� |
| C�������²��NaHSO3��Һ��pHС��7 |
| D��ʵ����ʢ��Na2CO3��Һ���Լ�ƿ������ĥ�ڲ����� |
�����£�0.1mol��L��1CH3COONa��Һ�У���Ũ�ȼ��ϵ��ȷ����
| A��c(Na+)=c(CH3COO��) ��c(OH��)=c(H+) |
| B��c(OH��)=c(H+)+ c(CH3COOH) |
| C��c(Na+) + c(H+)= c(CH3COO��) +c(OH��) |
| D��c(CH3COOH) + c(CH3COO��) = c(Na+)+ c(H+) |

 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2