题目内容
【题目】聚乙烯醇具有亲水性和成膜性,在适宜的浓度下,能起类似人工泪液的作用,作为润滑剂预防或治疗眼部刺激症状。聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)“洗衣凝珠”是由一层薄膜包裹洗衣液制成的新型洗涤产品,该薄膜的主要化学成分是可溶于水的聚乙烯醇(简称PVA)塑料,聚乙烯醇的化学式为(C2H4O)n,试回答:聚乙烯醇属于_____(填“金属材料”、“有机合成材料”、“硅酸盐材料”、“复合材料”之一),从物质结构的角度解释聚乙烯醇具有亲水性的原因___________________________。
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___(填增大、减小或不变)。
(3)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH____0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____(保留2位有效数字)。A、B、C、D四点中,v逆最大的是___,v正最大的是____。
(4)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____。
a.参与了醇解反应,但并不改变反应历程 b.提高乙酸甲酯的平衡转化率
c.提高了醇解反应的活化能 d.使k正和k逆增大相同倍数
【答案】有机合成材料 聚乙烯醇分子中含有大量羟基,易与水分子之间形成氢键 1:2 不变 > 3.2 C A d
【解析】
(1)由题意可知聚乙烯醇属于有机合成材料;聚乙烯醇含有羟基,具有亲水性,烃基则具有憎水性;
(2)投料比不同,转化率大小的比较,对于给定的化学反应,化学平衡常数仅受温度影响;
(3)吸热反应温度越高反应物的转化率越大,放热反应温度越高反应物的转化率越小,结合图形判断温度的变化对速率的影响,温度对化学反应速率的影响,温度越高反应速率越快;
(4)理解催化剂在反应中,参与反应历程,降低反应的活化能,但是不改变反应热,不改变平衡常数,不改变平衡转化率。
(1)聚乙烯醇属于有机合成材料;聚乙烯醇中含有大量的亲水基团羟基,并且羟基与水分子之间可以形成氢键;
(2)两种反应物,当乙酸甲酯的物质的量一定时,己醇的投入的量越大,乙酸甲酯的转化率越大,故初始投料比1:2的时候,乙酸甲酯转化率最大;对于给定的化学反应方程式,化学平衡常数只受温度的影响,与投料比的多少没有关系,与按1:2投料相比,按2:1投料时化学平衡常数Kx不变;
(3)温度越高反应速率越快,反应到达平衡的时间越短,①曲线的温度为348K,②曲线的温度为343K,③曲线的温度为338K,从图形上可知,温度越高乙酸甲酯转化率越大,故该反应为吸热反应,ΔH>0; CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l),由方程式可知,反应物的化学计量数之比与投料比相同,故CH3COOCH3(l)、C6H13OH(l)的转化率相同,①曲线的温度348K时,平衡时的转化率为64%,设初始投料时n(CH3COOCH3(l))=n(C6H13OH)=xmol,则达到平衡时,n(CH3COOCH3) =n(C6H13OH) =0.36xmol,n(CH3COOC6H13)=n(CH3OH) =0.64xmol,平衡时它们的物质的量分数分别为:X(CH3COOCH3)=X(C6H13OH)=(0.36xmol)/(0.36xmol+0.36xmol+0.64xmol+0.64xmol) ×100%=18%,X(CH3COOC6H13)=X(CH3OH)= (0.64xmol)/(0.36xmol+0.36xmol+0.64xmol
CH3COOC6H13(l)+CH3OH(l),由方程式可知,反应物的化学计量数之比与投料比相同,故CH3COOCH3(l)、C6H13OH(l)的转化率相同,①曲线的温度348K时,平衡时的转化率为64%,设初始投料时n(CH3COOCH3(l))=n(C6H13OH)=xmol,则达到平衡时,n(CH3COOCH3) =n(C6H13OH) =0.36xmol,n(CH3COOC6H13)=n(CH3OH) =0.64xmol,平衡时它们的物质的量分数分别为:X(CH3COOCH3)=X(C6H13OH)=(0.36xmol)/(0.36xmol+0.36xmol+0.64xmol+0.64xmol) ×100%=18%,X(CH3COOC6H13)=X(CH3OH)= (0.64xmol)/(0.36xmol+0.36xmol+0.64xmol
+0.64xmol) ×100%=32%,348K时,以物质的量分数表示的化学平衡常数Kx=![]() =3.2;C点的时候,生成物浓度比较大,温度比较高,故逆反应速率最大;A点的时候,反应物浓度比较大,温度比较高,A点的时候,正反应速率比较大;
=3.2;C点的时候,生成物浓度比较大,温度比较高,故逆反应速率最大;A点的时候,反应物浓度比较大,温度比较高,A点的时候,正反应速率比较大;
(4)a.催化剂参与反应,改变反应历程,a错误;
b.催化剂不能改变平衡移动的方向,不能改变平衡时反应物的转化率,b错误;
c.催化剂降低反应的活化能,c错误;
d.催化剂降低反应的活化能,能同等倍数的提高正、逆反应速率,d正确;
答案选d。

 阅读快车系列答案
阅读快车系列答案【题目】合成氨工业中的原料气制取与净化是重要的环节。
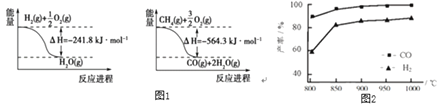
(1)已知有关反应的能量变化如图1:写出![]() 与
与![]() 反应制取
反应制取![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
(2)“![]() 催化重整法”制氢气:
催化重整法”制氢气:![]() ,
,![]() 不仅可以得到合成气
不仅可以得到合成气![]() 和
和![]() ,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
①根据键能计算,该反应的![]() ______
______![]() 。
。
化学键 | C-H | C=O | H-H |
|
键能kJ/mol | 413 | 745 | 436 | 1075 |
②按一定体积比加入![]() 和
和![]() ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和![]() 产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
③某温度下,将![]() 、
、![]() 以及催化剂进行加入
以及催化剂进行加入![]() 容器中,达到平衡时
容器中,达到平衡时![]() ,平衡常数
,平衡常数![]() ______
______![]() 。
。
(3)合成气在进入合成塔前常用醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 溶液来吸收其中的CO杂质,其反应是:
溶液来吸收其中的CO杂质,其反应是:![]() ,必须除去原料气中CO的原因是______。醋酸二氨合铜
,必须除去原料气中CO的原因是______。醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 吸收CO的生产适宜条件应是______
吸收CO的生产适宜条件应是______![]() 填序号
填序号![]() 。
。
A.高温高压 B.高温低压 C.低温高压 D.低温低压