题目内容
10.在某溶液中加入AgNO3溶液,再加入稀硝酸,有白色沉淀出现,则该溶液 ( )| A. | 必定是可溶性氯化物 | B. | 可能是可溶性碳酸盐 | ||
| C. | 可能含有Cl- | D. | 必定是氯水 |
分析 在某溶液中加入AgNO3溶液,再加入稀硝酸,有白色沉淀出现是氯离子的检验方法,说明溶液中一定含有Cl-.
解答 解:A、溶液中加入AgNO3溶液,再加入稀硝酸,有白色沉淀出现是氯离子的检验方法,说明溶液中一定含有Cl-,必定是可溶性氯化物,故A正确;
B、可溶性碳酸盐溶液中加入AgNO3溶液,再加入稀硝酸不会有沉淀生成,故B错误;
C、溶液中一定含有氯离子,故C错误;
D、上述分析可知必定是可溶性氯化物,不一定是氯水,可以是盐酸、含氯离子的盐等,故D错误;
故选A.
点评 本题考查了离子检验的实验方法和反应现象分析判断,掌握基础是解题关键,题目较简单.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
20.1molC2H4和Cl2完全加成,再与Cl2光照条件下发生取代反应,所有氢原子被氯原子取代,则共消耗Cl2的物质的量是( )
| A. | 6mol | B. | 5mol | C. | 4mol | D. | 3mol |
1.化合物A、B结构如图所示.下列关于两种有机化合物A、B的说法正确的是( )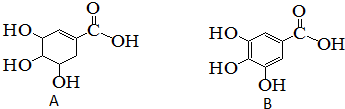
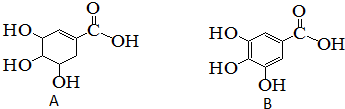
| A. | 化合物A和B遇三氯化铁溶液都显紫色 | |
| B. | 化合物A和B中所含官能团相同 | |
| C. | 等物质的量的A和B分别与足量的NaOH溶液反应,消耗NaOH的量相同 | |
| D. | 化合物A和B都能与溴水反应 |
18.下列有关原电池的判断错误的是( )
①所有金属都能作电极
②有活泼性不同的两种金属电极、有电解质溶液、导线就一定能构成原电池,对外放电
③原电池放电实现化学能转化为电能
④以铁、铜为电极,在稀硫酸溶液中构成原电池,负极反应式为Fe-3e-═Fe3+.
①所有金属都能作电极
②有活泼性不同的两种金属电极、有电解质溶液、导线就一定能构成原电池,对外放电
③原电池放电实现化学能转化为电能
④以铁、铜为电极,在稀硫酸溶液中构成原电池,负极反应式为Fe-3e-═Fe3+.
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
15.下列实验方法或操作能达到实验目的是( )


| A. | 图1:石油分馏 | B. | 图2:配制150mL 0.1mol/L盐酸 | ||
| C. | 图3:烧瓶内溶液变蓝色 | D. | 图4:探究NaHCO3的热稳定性 |
13.碳和碳的化合物在生产、生活中的应用非常广泛,“低碳生活”已成潮流,清洁能源的开发、煤的综合利用等是实现“低碳生活”的重要途径.试运用所学知识,回答下列问题:
(1)甲烷是一种重要的清洁燃料
①甲烷燃烧放出大量的热,可直接作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1;请从化学反应的本质解释甲烷燃烧放出热量的原因:化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量.
②在甲烷燃料电池中,甲烷的化学能利用率大大提高.将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,其负极电极反应式是:CH4-8e-+10 OH-=CO32-+7H2O.
(2)二甲醚也是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.
①利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ/mol
该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是bd (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
②二甲醚也可以通过CH3OH分子间脱水制得
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
已知在280℃,体积不变的密闭容器中进行上述反应,t2时达到平衡,各组分起始和平衡浓度见下表.
①表中c1=1.
在t2min内平均反应速率v(H2O)=$\frac{1}{2{t}_{2}}$mol/(L.min).
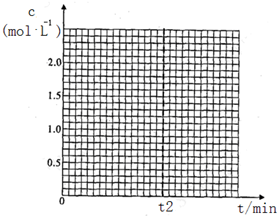
②若在400℃,相同的密闭容器中进行上述反应,请在下图中画出CH3OCH3浓度随时间变化的关系图(要求同时画出280℃的,并做好标注).
(1)甲烷是一种重要的清洁燃料
①甲烷燃烧放出大量的热,可直接作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1;请从化学反应的本质解释甲烷燃烧放出热量的原因:化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量.
②在甲烷燃料电池中,甲烷的化学能利用率大大提高.将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,其负极电极反应式是:CH4-8e-+10 OH-=CO32-+7H2O.
(2)二甲醚也是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.
①利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ/mol
该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是bd (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
②二甲醚也可以通过CH3OH分子间脱水制得
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
已知在280℃,体积不变的密闭容器中进行上述反应,t2时达到平衡,各组分起始和平衡浓度见下表.
| CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| 起始浓度 mol/L | 2.00 | 0.50 | 0 |
| 平衡浓度 mol/L | c1 | 1.00 | c2 |
在t2min内平均反应速率v(H2O)=$\frac{1}{2{t}_{2}}$mol/(L.min).
②若在400℃,相同的密闭容器中进行上述反应,请在下图中画出CH3OCH3浓度随时间变化的关系图(要求同时画出280℃的,并做好标注).

14.下列叙述正确的是( )
| A. | 稀醋酸中加入少量醋酸钠固体能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液呈中性 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 |