题目内容
2.有下列物质,按要求填空CaCl2、PH3、H2O2、Na2O2、KOH、(NH4)2SO4、F2
A.只由离子键构成的物质CaCl2;
B.只由极性键构成的物质PH3;
C.只由非极性键构成的物质F2;
D.只由非金属元素组成的离子化合物(NH4)2SO4.
E.写出Na2O2的电子式
 .
.
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,不同非金属形成极性键,同种非金属形成非极性键,以此来解答.
解答 解:CaCl2中只含离子键;
PH3中只含P-H极性键;
H2O2中含H-O极性键和O-O非极性键;
Na2O2中含离子键和O-O非极性键;
KOH中含离子键和O-H极性键;
(NH4)2SO4中含离子键和极性键;
F2中只含非极性键,则
A.只由离子键构成的物质为CaCl2,故答案为:CaCl2;
B.只由极性键构成的物质为PH3,故答案为:PH3;
C.只由非极性键构成的物质为F2,故答案为:F2;
D.只由非金属元素组成的离子化合物为(NH4)2SO4,故答案为:(NH4)2SO4;
E.Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查化学键,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意铵盐为特殊的离子化合物,题目难度不大.

练习册系列答案
相关题目
18.下列有关原电池的判断错误的是( )
①所有金属都能作电极
②有活泼性不同的两种金属电极、有电解质溶液、导线就一定能构成原电池,对外放电
③原电池放电实现化学能转化为电能
④以铁、铜为电极,在稀硫酸溶液中构成原电池,负极反应式为Fe-3e-═Fe3+.
①所有金属都能作电极
②有活泼性不同的两种金属电极、有电解质溶液、导线就一定能构成原电池,对外放电
③原电池放电实现化学能转化为电能
④以铁、铜为电极,在稀硫酸溶液中构成原电池,负极反应式为Fe-3e-═Fe3+.
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
13.碳和碳的化合物在生产、生活中的应用非常广泛,“低碳生活”已成潮流,清洁能源的开发、煤的综合利用等是实现“低碳生活”的重要途径.试运用所学知识,回答下列问题:
(1)甲烷是一种重要的清洁燃料
①甲烷燃烧放出大量的热,可直接作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1;请从化学反应的本质解释甲烷燃烧放出热量的原因:化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量.
②在甲烷燃料电池中,甲烷的化学能利用率大大提高.将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,其负极电极反应式是:CH4-8e-+10 OH-=CO32-+7H2O.
(2)二甲醚也是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.
①利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ/mol
该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是bd (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
②二甲醚也可以通过CH3OH分子间脱水制得
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
已知在280℃,体积不变的密闭容器中进行上述反应,t2时达到平衡,各组分起始和平衡浓度见下表.
①表中c1=1.
在t2min内平均反应速率v(H2O)=$\frac{1}{2{t}_{2}}$mol/(L.min).
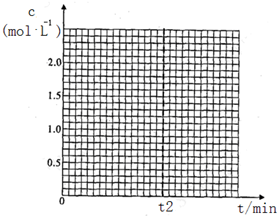
②若在400℃,相同的密闭容器中进行上述反应,请在下图中画出CH3OCH3浓度随时间变化的关系图(要求同时画出280℃的,并做好标注).
(1)甲烷是一种重要的清洁燃料
①甲烷燃烧放出大量的热,可直接作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1;请从化学反应的本质解释甲烷燃烧放出热量的原因:化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量.
②在甲烷燃料电池中,甲烷的化学能利用率大大提高.将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,其负极电极反应式是:CH4-8e-+10 OH-=CO32-+7H2O.
(2)二甲醚也是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.
①利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ/mol
该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是bd (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
②二甲醚也可以通过CH3OH分子间脱水制得
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
已知在280℃,体积不变的密闭容器中进行上述反应,t2时达到平衡,各组分起始和平衡浓度见下表.
| CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| 起始浓度 mol/L | 2.00 | 0.50 | 0 |
| 平衡浓度 mol/L | c1 | 1.00 | c2 |
在t2min内平均反应速率v(H2O)=$\frac{1}{2{t}_{2}}$mol/(L.min).
②若在400℃,相同的密闭容器中进行上述反应,请在下图中画出CH3OCH3浓度随时间变化的关系图(要求同时画出280℃的,并做好标注).

10.目前“低碳经济”正成为科学家研究的主要课题.请回答下列问题:
Ⅰ.(1)甲烷自热重整是一种先进的制氢方法,其反应方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)
阅读下图,计算该反应的反应热△H=+161.1kJ/mol.

(2)以CH4、O2为原料,100mL0.15mol/LNaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
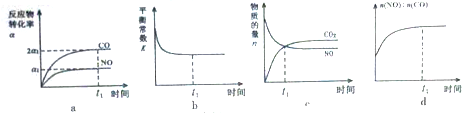
Ⅱ.一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是AD(选填字母).
Ⅲ.相同温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
请回答:
(1)n=19.6kJ.
(2)若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol•L-1•s-1.
Ⅰ.(1)甲烷自热重整是一种先进的制氢方法,其反应方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)
阅读下图,计算该反应的反应热△H=+161.1kJ/mol.

(2)以CH4、O2为原料,100mL0.15mol/LNaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
Ⅱ.一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是AD(选填字母).

Ⅲ.相同温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | C1 | C2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
(1)n=19.6kJ.
(2)若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol•L-1•s-1.
17.氮和钠可形成化合物Na3N,它能与水剧烈反应产生NH3,下列叙述正确的是( )
| A. | Na3N与水的反应是氧化还原反应 | |
| B. | Na3N 是共价化合物 | |
| C. | Na3N中4个离子均满足最外层8电子稳定结构 | |
| D. | Na3N中钠离子半径大于氮离子半径 |
7.下列物质的转化在给定条件下能实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 | |
| B. | MgCO3$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| C. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| D. | SiO2$\stackrel{HCl}{→}$SiCl4$\stackrel{H_{2}}{→}$Si |
14.下列叙述正确的是( )
| A. | 稀醋酸中加入少量醋酸钠固体能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液呈中性 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 |
12.下列叙述不正确的是( )
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | 应用盖斯定律可计算某些难以直接测量的反应焓变 | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,则氢气的燃烧热为285.8kJ/mol |