题目内容
3.将过量铁放入100mL 18.4mol/L的浓硫酸中,微热完全反应后,得到的气体相对于H2的平均分子质量为10,求参加反应的Fe有多少mol.分析 设参加反应的Fe为xmol,反应生成的SO2为ymol.因反应得到的气体相对于H2的平均分子质量为10,即得到的气体为SO2和H2的混合气体,根据十字交叉,得n(SO2):n(H2)=(2×10-2):(64-2×10)=9:22,即n(H2)=$\frac{22ymol}{9}$,又n(H2SO4)=1.84mol,铁过量反应后生成Fe2+,则由硫元素守恒和电子守恒列式求解.
解答 解:设参加反应的Fe为xmol,反应生成的SO2为ymol.因反应得到的气体相对于H2的平均分子质量为10,即得到的气体为SO2和H2的混合气体,根据十字交叉,得n(SO2):n(H2)=(2×10-2):(64-2×10)=9:22,即n(H2)=$\frac{22ymol}{9}$,又n(H2SO4)=1.84mol,铁过量反应后生成Fe2+,则由硫元素守恒和电子守恒得:x+$\left\{\begin{array}{l}{x+y=1.84}\\{2x=2y+\frac{22y}{9}×2}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{x=1.426}\\{y=0.414}\end{array}\right.$,故参加反应的Fe有1.426mol,
答:参加反应的Fe有1.426mol.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,属于常考题.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
18.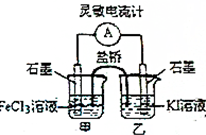 控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
 控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )| A. | 反应开始时,电子从甲池电极移向乙池电极 | |
| B. | 平衡时电流表指针为零,两池溶液颜色相同 | |
| C. | 平衡时Fe3+氧化性比I2强 | |
| D. | 平衡时向甲池中溶入FeCl2固体后,乙池的石墨电极为正极 |
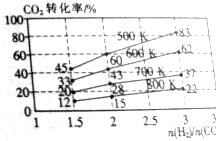
8.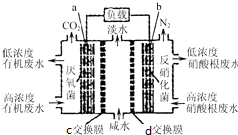 一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )
一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )
 一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )
一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )| A. | 电子从a极经负载到b极 | |
| B. | c为氯离子交换膜,d为钠离子交换膜,中间室可用作海水淡化 | |
| C. | 负极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | 反应后将左右两室溶液混合较反应前两室溶液混合的酸性强 |
12.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
| A. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
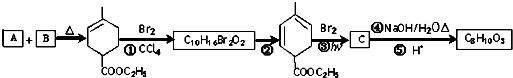
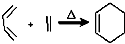 RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.请按要求回答下列问题:
RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.请按要求回答下列问题: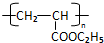 .
.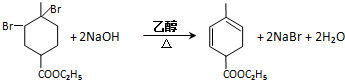 .
.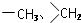 均2个,反应④的化学方程式为
均2个,反应④的化学方程式为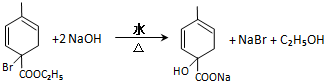 .
. .
.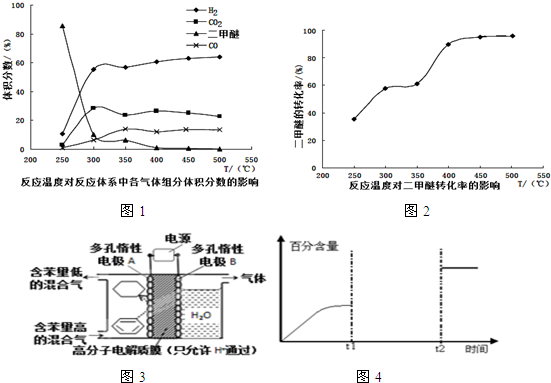
 .
. 一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示. 氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化.
氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化.