题目内容
11. 一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.(1)降低温度,平衡向正反应方向移动;
(2)在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,H2的转化率为20%,若达到平衡后H2的浓度为a mol•L-1,则达到平衡时CH2CH2OH的浓度为0.042amol/L.
分析 (1)由图可知,横坐标为投料比,纵坐标为CO2的转化率,曲线为等温线,则相同投料比时温度低对应的CO2的转化率大;
(2)700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,投料比等于化学计量数之比,则H2的转化率=CO2的转化率,若达到平衡后H2的浓度为a mol•L-1,起始氢气为$\frac{a}{1-20%}$mol/L=1.25amol/L,结合反应计算生成的CH2CH2OH.
解答 解:(1)由图可知,横坐标为投料比,纵坐标为CO2的转化率,曲线为等温线,则相同投料比时温度低对应的CO2的转化率大,即降低温度平衡正反应方向移动,
故答案为:正反应;
(2)700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,投料比等于化学计量数之比,则H2的转化率=CO2的转化率,均为20%,若达到平衡后H2的浓度为a mol•L-1,起始氢气为$\frac{a}{1-20%}$mol/L=1.25amol/L,则转化的氢气为0.25amol/L,由反应可知达到平衡时CH2CH2OH的浓度为0.25amol/L×$\frac{1}{6}$=0.042amol/L,
故答案为:20%;0.042amol/L.
点评 本题考查平衡图象及计算,为高频考点,把握图中坐标的含义、曲线的含义及平衡影响因素、平衡计算为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
1.下列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
x?Y
x?Y
| 物质 选项 | X | Y |
| A | Na2CO3 | NaHCO3 |
| B | Al(OH)3 | Al2O3 |
| C | FeCl3 | FeCl2 |
| D | CuSO4 | Cu(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
2.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(H+)+c(Cl-)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
19.元素周期表中元素的性质存在递变规律,下列关系正确的是 ( )
| A. | 离子半径:S2->Na+>O2->H+ | B. | 与水反应的剧烈程度:K>Na>Mg>Ca | ||
| C. | 熔点:CO2>SiO2>Na2O>SO3 | D. | 还原性:PH3>H2S>HCl>HF |
6.已知某种气态化石燃料只含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体(包括水)全部通入如图所示的装置,得到如表所示的实验数据(左侧U形管中干燥剂至吸收水蒸气且假设产生的气体完全被吸收,忽略澄清石灰水中的水分损失)
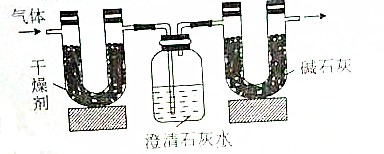
根据实验数据回答下列问题:
(1)实验完毕后,生成物中水的质量为1.35g,假设广口瓶里生成一种正盐,其质量为5g
(2)生成的水中氢元素的质量为0.15g.
(3)生成的CO2中碳元素的质量为0.6g.
(4)气态化石燃料的分子式为C2H6.

| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 51.10g | 52.45g |
| (澄清石灰水+广口瓶)的质量 | 408.00g | 410.20 |
(1)实验完毕后,生成物中水的质量为1.35g,假设广口瓶里生成一种正盐,其质量为5g
(2)生成的水中氢元素的质量为0.15g.
(3)生成的CO2中碳元素的质量为0.6g.
(4)气态化石燃料的分子式为C2H6.
16.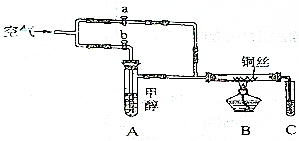 如图所示装置,通入空气,开启a、b两个活塞,灼热铜丝,下列有关分析正确的是( )
如图所示装置,通入空气,开启a、b两个活塞,灼热铜丝,下列有关分析正确的是( )
 如图所示装置,通入空气,开启a、b两个活塞,灼热铜丝,下列有关分析正确的是( )
如图所示装置,通入空气,开启a、b两个活塞,灼热铜丝,下列有关分析正确的是( )| A. | 灼热铜丝发生的现象变化为紫红色和黑色交替出现,甲醇发生还原反应 | |
| B. | C中有机产物易溶于水,与水分子间只形成1种氢键 | |
| C. | 检验C中产物的试剂可用1mol•L-1的CuSO4溶液2mL和0.4mol•L-1的NaOH | |
| D. | 可用酸性高锰酸钾溶液检验产物生成 |
20.下列化合物的一氯代物的数目排列顺序正确的是( )
①CH3CH2CH2CH2CH2CH3②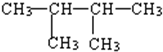 ③
③ ④
④
①CH3CH2CH2CH2CH2CH3②
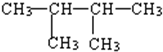 ③
③ ④
④
| A. | ①>②>③>④ | B. | ③=①>②>④ | C. | ③>②>④>① | D. | ②>③=①>④ |
6.下列实验操作可以达到实验目的是( )
| A. | 用铝片与氧化铁混合加热进行铝热反应 | |
| B. | 将蔗糖溶于水,加热几分钟后再加人少量新制的Cu(OH)2就可实现将蔗糖水解,并用新制的Cu(OH)2检验蔗糖的水解产物 | |
| C. | 用溴的四氯化碳溶液就能鉴别乙烷与乙烯 | |
| D. | 向裂化汽油中加人酸性高锰酸钾溶液,振荡,紫色褪去说明汽油中含有甲苯等苯的同系物 |