题目内容
12.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )| A. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
分析 A.pH=7,则c(H+)=c(OH-),结合电荷守恒分析;
B.溶液中钠离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(Na+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立判断;
C.未反应前结合物料守恒可知c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)],向0.10mol•L-1Na2SO3溶液通入SO2,至溶液pH=7,反应后溶液中溶质为NaHSO3、Na2SO3;
D.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,反应后溶液中溶质为NaCl、醋酸和醋酸钠.
解答 解:A.pH=7,则c(H+)=c(OH-),结合电荷守恒可知,c(NH4+)=c(HCO3-)+2c(CO32-),故A错误;
B.溶液中钠离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,故c(Na+)>c(NH4+),由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(Na+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立可得:c(NH4+)+c(H2SO3)=c(SO32-),故B错误;
C.向0.10mol•L-1Na2SO3溶液通入SO2,发生Na2SO3+SO2+H2O=2NaHSO3,至溶液pH=7,反应后溶液中溶质为的NaHSO3、Na2SO3,则c(Na+)<2[c(SO32-)+c(HSO3-)+c(H2SO3)],故C错误;
D.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,c(H+)=c(OH-),HCl不足,反应后溶液中溶质为NaCl、醋酸和醋酸钠,由电荷守恒可知,c(Na+)=c(CH3COO-)+c(Cl-),由物料守恒可知,c(Na+)=c(CH3COOH)+c(CH3COO-),则c(Na+)>c(CH3COOH)=c(Cl-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,为2015年江苏高考题,把握发生的反应、盐类水解及电离为解答的关键,注意pH=7的信息及应用,题目难度不大.

| A. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(H+)+c(Cl-)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
①CH3CH2CH2CH2CH2CH3②
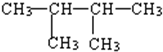 ③
③ ④
④
| A. | ①>②>③>④ | B. | ③=①>②>④ | C. | ③>②>④>① | D. | ②>③=①>④ |
| A. | 气体的摩尔体积是22.4L | |
| B. | 1L 1mol/L MgCl2溶液中Cl-的物质的量浓度为1mol/L | |
| C. | 1mol NaOH的质量为40g | |
| D. | 1mol氧和1mol水所含的分子数相等 |
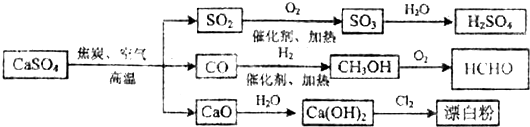
| A. | 除去与水反应外,图示中其它的转化反应均为氧化还原反应 | |
| B. | CO、SO2、SO3 均是酸性氧化物 | |
| C. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| D. | 用CO合成CH3OH 进而合成HCHO的两步反应,原子利用率均为100% |
| A. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理相同 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关 | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |
| A. | 用铝片与氧化铁混合加热进行铝热反应 | |
| B. | 将蔗糖溶于水,加热几分钟后再加人少量新制的Cu(OH)2就可实现将蔗糖水解,并用新制的Cu(OH)2检验蔗糖的水解产物 | |
| C. | 用溴的四氯化碳溶液就能鉴别乙烷与乙烯 | |
| D. | 向裂化汽油中加人酸性高锰酸钾溶液,振荡,紫色褪去说明汽油中含有甲苯等苯的同系物 |
| A. | 生石灰能与水反应,可用来干燥氯气 | |
| B. | 氯化铝是一种电解质,可用于电解法制铝 | |
| C. | 液氨汽化时要吸收大量的热,可用做制冷剂 | |
| D. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |