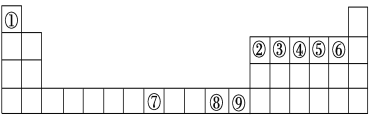
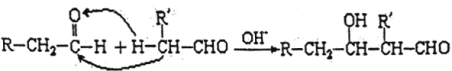
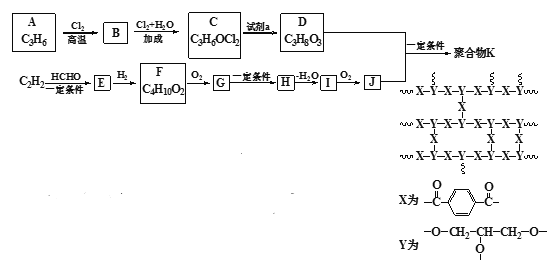
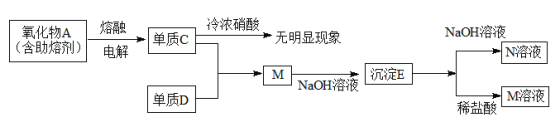
题目内容
【题目】工业排放物可能对环境和人体健康产生危害,必须经过处理才可排放。根据题意回答下列问题。
Ⅰ.处理含SO2、NO的烟气
在323 K温度下,向盛有NaClO2溶液的鼓泡反应器中通入含有SO2和NO的烟气。
(1)写出NaClO2溶液脱硝过程中反应的离子方程式___________________ 。
(2)由实验测得,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)采用NaClO、Ca(ClO) 2替代NaClO2,也能较好的除去SO2。从化学平衡原理分析,Ca(ClO) 2相比NaClO具有的优点是___________________。
Ⅱ.处理含H2S的烟气
生物脱H2S原理为:
H2S(g) + Fe2(SO4)3(aq) = S(s) + 2FeSO4(aq) + H2SO4(aq) ΔH1
4FeSO4(aq) + O2(g) + 2H2SO4(aq) ![]() 2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
(1)反应2H2S(g) + O2 (g) = 2S(s) + 2H2O(l) 的ΔH3=___________________。
(2)若反应温度过高,反应速率下降(如图),其原因是______________。

Ⅲ.处理污水的化学方法有许多,混凝法、氧化还原法、中和法、电解法等。处理含Na2SO4的废水常用三室式电渗析法,原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

(1)负极反应式为___________________。
(2)当电路中通过1![]() 电子的电量时,会有_________
电子的电量时,会有_________![]() 的O2生成。
的O2生成。
【答案】2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+ (或2H2O+ClO2-+4NO=4NO2-+Cl-+4H+) 二氧化硫的还原性强于NO 生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行 ΔH3=2ΔH1+ΔH2 蛋白质变性(或硫杆菌失去活性) 2H2O+2e—=H2↑+2OH— 0.25
【解析】
Ⅰ.(1)NaClO2具有氧化性,可以将NO氧化为硝酸根或亚硝酸根,根据电荷守恒及原子守恒分析水参加反应,产物中有H+生成,则反应的离子方程式为2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+(或2H2O+ClO2-+4NO=4NO2-+Cl-+4H+)。故答案为:2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+(或2H2O+ClO2-+4NO=4NO2-+Cl-+4H+);
(2)由实验测得,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强于NO,故答案为:二氧化硫的还原性强于NO;
(3)采用NaClO、Ca(ClO) 2替代NaClO2,也能较好的除去SO2。从化学平衡原理分析,Ca(ClO) 2相比NaClO具有的优点是:生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行,故答案为:生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行;
Ⅱ.(1)已知:①H2S(g) + Fe2(SO4)3(aq) = S(s) + 2FeSO4(aq) + H2SO4(aq) ΔH1,②4FeSO4(aq) + O2(g) + 2H2SO4(aq) ![]() 2Fe2(SO4)3(aq) + 2H2O(l) ΔH2,
2Fe2(SO4)3(aq) + 2H2O(l) ΔH2,
根据盖斯定律①×2+②得反应2H2S(g) + O2 (g) = 2S(s) + 2H2O(l) ,则ΔH3=2ΔH1+ΔH2,故答案为:故ΔH3=2ΔH1+ΔH2;
(2)根据题给方程式知,硫杆菌在反应中作催化剂,温度过高时会失去活性,因此反应速率下降,故答案为:蛋白质变性(或硫杆菌失去活性);
Ⅲ.(1)阴极发生还原反应,根据放电顺序氢离子得电子生成氢气,反应式为:2H2O+2e-=H2↑+2OH-,故答案为:2H2O+2e-=H2↑+2OH-;
(2)电解硫酸钠溶液相当于电解水,阳极发生氧化反应生成氧气,电极反应为:2H2O-4e-=4H++O2↑,则当电路中通过1![]() 电子的电量时,会有1
电子的电量时,会有1![]() ×
×![]() =0.25mol O2生成,故答案为:0.25。
=0.25mol O2生成,故答案为:0.25。

【题目】温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
温度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )
A. 该反应的正反应为放热反应
B. T2温度下此反应的平衡常数K=4
C. 温度为T1时,0~t1时间段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数增大