题目内容
17.A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族.A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,E 是地壳中含量最高的金属元素.根据以上信息回答下列问题:(1)甲、乙两分子中含有非极性共价键的物质的电子式是
 ,E离子的电子排布式为1s22s22p6,B原子的电子排布图为
,E离子的电子排布式为1s22s22p6,B原子的电子排布图为 .
.(2)根据对角线规则,Be与Al性质相似,写出Be与DBA溶液反应的离子方程式Be+2OH-=BeO22-+H2↑
(3)C、D、E可组成离子化合物DxEC6,该化合物的化学式是Na3AlF6,该物质为配合物,其中中心原子为Al,内界为[AlF6]3-.
(4)若要说明非金属元素X比元素Y(X、Y均为非稀有气体元素)的非金属性强,则下列方法正确的是①③④⑤(填序号).
①X单质可以把Y从其氢化物中置换出来
②X原子的最外层电子数比Y原子的最外层电子数多
③X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
④与H2化合时X单质比Y单质容易
⑤电负性:X>Y
⑥I1(X)>I1 (Y)
分析 A、B、C、D、E都是短周期元素,原子序数依次增大,A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,这两种液态化合物是水、双氧水,则甲是H2O、乙是H2O2,A是H元素、B是O元素;
A、D同一主族且D原子序数大于O,则D为Na元素;
E是地壳中含量最高的金属元素,则E是Al元素;
B、C同一周期,C原子序数大于B,C能和其它元素形成化合物,则C是F元素,
再结合题目分析解答.
解答 解:A、B、C、D、E都是短周期元素,原子序数依次增大,A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,这两种液态化合物是水、双氧水,则甲是H2O、乙是H2O2,A是H元素、B是O元素;
A、D同一主族且D原子序数大于O,则D为Na元素;
E是地壳中含量最高的金属元素,则E是Al元素;
B、C同一周期,C原子序数大于B,C能和其它元素形成化合物,则C是F元素,
(1)甲、乙两分子中含有非极性共价键的物质是双氧水,双氧水分子中O-H原子之间存在极性键、O-O原子之间存在非极性键,电子式为 ;
;
E是铝元素,其离子核外有10个电子,根据构造原理知其核外电子排布式为1s22s22p6;
B是O元素,其原子核外电子排布图为 ,
,
故答案为: ;1s22s22p6;
;1s22s22p6; ;
;
(2)DBA为NaOH,Be的性质和Al性质相似,则Be和NaOH反应生成盐和氢气,离子反应方程式为Be+2OH-=BeO22-+H2↑,
故答案为:Be+2OH-=BeO22-+H2↑;
(3)C是F元素、D是Na元素、E是Al元素,F元素在化合物中化合价为-1价、Al为+3价、Na为+1价,根据化合物中各元素化合价的代数和为0知,x=3,其化学式为Na3AlF6,其內界是Al原子,外界为[AlF6]3-,
故答案为:Na3AlF6;Al;[AlF6]3-;
(4)①元素的非金属性越强,其单质的氧化性越强,X单质可以把Y从其氢化物中置换出来,则X的氧化性大于Y单质,所以非金属性X>Y,故正确;
②X原子的最外层电子数比Y原子的最外层电子数多不能说明非金属性X>Y,非金属性强弱与得电子难易程度有关,故错误;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强,X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强,说明非金属性X>Y,故正确;
④元素的非金属性越强,其单质与氢气化合越容易,所以与H2化合时X单质比Y单质容易,说明非金属性X>Y,故正确;
⑤元素的非金属性越强,其电负性越大,电负性:X>Y,说明非金属性X>Y,故正确;
⑥I1(X)>I1 (Y),不能说明非金属性X>Y,如第一电离能N>O,但非金属性O>N,故错误;
故选①③④⑤.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及物质结构、配合物、非金属性强弱判断等知识点,非金属性强弱与得电子难易程度有关,与得电子多少无关,为易错点.

| A. | 用酒精灯火焰的外焰部分直接加热蒸发皿底部 | |
| B. | 蒸发液体时,边加热边用玻璃棒不断搅动蒸发皿里的液体直到把液体完全蒸干 | |
| C. | 将热的蒸发皿用手拿离火焰,放在实验台上 | |
| D. | 将灼热的蒸发皿直接放在冰水中冲洗 |
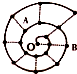 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )| A. | 同一虚线相连的元素离O点越远的原子半径越大 | |
| B. | A、B处于同一周期 | |
| C. | A元素是图中非金属性最强的元素 | |
| D. | A、B组成的化合物中不可能含有共价键 |
| A. | 镍基含铼单晶合金属于金属晶体 | |
| B. | ${\;}_{75}^{185}$Re和 ${\;}_{75}^{187}$Re互称为核素 | |
| C. | 铼(Re)元素的相对原子质量为186 | |
| D. | 含铼合金比纯铼的熔点高、硬度大 |
| A. | 与煤相比,天然气是较清洁的化石燃料 | |
| B. | 煤的干馏和石油的分馏都是物理变化 | |
| C. | 煤燃烧产生的硫氧化物和氮氧化物是形成酸雨的主要物质 | |
| D. | 苯可从煤焦油中提取,它是广泛应用的化工原料,有特殊气味,有毒 |
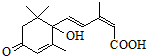 对盆栽鲜花施用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
对盆栽鲜花施用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )| A. | 含有碳碳双键、苯环、羟基、羰基 | |
| B. | 含有碳碳双键、羟基、羰基、羧基 | |
| C. | 1 mol该物质能与5 mol H2发生加成反应 | |
| D. | 与等物质的量的溴单质发生加成反应可得3种产物 |
 某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写:
某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写: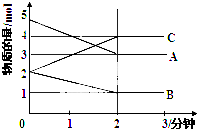 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,容器的体积为2L.由图中数据分析,反应开始至2min,C的平均反应速率为0.5mol/(L•min).化学方程式为2A+B?2C.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,容器的体积为2L.由图中数据分析,反应开始至2min,C的平均反应速率为0.5mol/(L•min).化学方程式为2A+B?2C.