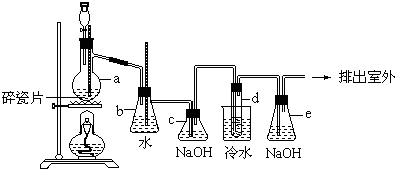
题目内容
2.(1)某无色透明溶液可能存在Na+、Fe3+、Ba2+、NO3-、CO32-、HCO3-、SO42-中的几种离子,现有如下操作:Ⅰ、取适量该溶液加入CaCl2溶液无沉淀,继续滴加盐酸产生无色无味的气体.
Ⅱ、另取该溶液滴加少量的NaOH溶液有白色沉淀生成.
试回答下列问题:
①该溶液中一定存在的离子有Ba2+、HCO3-,一定不存在的离子Fe3+、CO32-、SO42-.不能确定的离子有Na+、NO3-,其中阳离子的鉴别方法是焰色反应
②用一个离子方程式表示操作Ⅱ的实验现象:Ba2++HCO3-+OH-=BaCO3↓+H2O.
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3:2.完成下列化学方程式:
①28KMnO4+5K2S+24KOH═28K2MnO4+3K2SO4+2S↓+12H2O.
②若生成6.4g单质硫,反应过程中转移电子的物质的量为2.8mol.
分析 (1)①三价铁离子为黄色,溶液为无色透明,则一定不含有Fe3+,而硫酸钙为微溶物、碳酸钙为沉淀,硫酸根离子与钡离子能够反应生成硫酸钡沉淀,碳酸氢根离子能够与氢氧根离子反应生成碳酸根离子,碳酸根离子与钡离子结合生成沉淀,依据焰色反应可以确定所含金属离子,据此分析;
②碳酸氢根离子能够与氢氧根离子反应生成碳酸根离子,碳酸根离子与钡离子结合生成沉淀;
(2)①反应中Mn元素从+7价降为+6价,S 元素从-2价升高到+6价和0价,依据K2SO4和S的物质的量之比为3:2,所以5mol硫化钾生成硫酸钾和硫单质失去28mol电子,依据得失电子守恒、原子个数守恒配平方程式;
②依据方程式28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O可知,生成2molS,消耗28mol高锰酸钾,失去电子总数28mol×(7-6)=28mol,据此计算;
解答 解:(1)①三价铁离子为黄色,溶液为无色透明,则一定不含有Fe3+,
Ⅰ、取适量该溶液加入CaCl2溶液无沉淀,继续滴加盐酸产生无色无味的气体,说明不含碳酸根离子、含有碳酸氢根离子;
Ⅱ、另取该溶液滴加少量的NaOH溶液有白色沉淀生成,生成的沉淀只能为碳酸钡沉淀,溶液中一定含有钡离子,一定不含有硫酸根离子,钠离子、硝酸根离子不能确定;
所以一定含有的离子为:Ba2+、HCO3-;一定不含的离子为:Fe3+、CO32-、SO42-;不确定是:Na+、NO3-;
钠元素灼烧呈黄色火焰,所以通过焰色反应可以确定是否含有钠离子;
故答案为:Ba2+、HCO3-;Fe3+、CO32-、SO42-;Na+、NO3-;,焰色反应;
②碳酸氢根离子能够与氢氧根离子反应生成碳酸根离子,碳酸根离子与钡离子结合生成沉淀,反应的离子方程式:Ba2++HCO3-+OH-=BaCO3↓+H2O;
故答案为:Ba2++HCO3-+OH-=BaCO3↓+H2O;
(2)①反应中Mn元素从+7价降为+6价,S 元素从-2价升高到+6价和0价,依据K2SO4和S的物质的量之比为3:2,所以5mol硫化钾生成硫酸钾和硫单质失去28mol电子,得失电子的最小公倍数是28,所以高锰酸钾的计量数是28,硫化钾的计量数是5,依据原子个数守恒可知反应方程式:28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O;
故答案为:28 5 24KOH 28 3 2 12H2O;
②依据方程式28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O可知,生成2molS,消耗28mol高锰酸钾,失去电子总数28mol×(7-6)=28mol,则若生成6.4g单质硫,物质的量为0.2mol,反应过程中转移电子的物质的量为2.8mol;
故答案为:2.8mol.
点评 本题考查了离子的鉴别、氧化还原方程式的配平,熟悉常见离子的性质、氧化还原反应得失电子守恒规律是解题关键,题目难度中等.

 期末集结号系列答案
期末集结号系列答案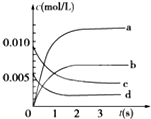 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
(1)二甲醚的核磁共振H谱图中有1个吸收峰,官能团名称是醚键.
(2)二甲醚、空气、氢氧化钾溶液、多孔石墨电极可构成燃料电池.该电池中负极的电极反应式是:CH3OCH3+16OH--12e-═2CO32-+11H2O,则正极的电极反应式是6H2O+3O2+12e-=12OH-.
(3)已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为225.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.60 | 0.60 |
②若开始只加入CH3OH,经10min后反应达到平衡,平衡时CH3OH转化率α (CH3OH) (计算结果用百分数表示,保留小数后一位).
| A. | Cl2 | B. | HClO | C. | ClO- | D. | HCl |
| A. | 苯和四氯化碳 | B. | 氢氧化钠固体和食盐 | ||
| C. | 石灰石和重晶石 | D. | 酒精和汽油 |
| A. | 铝有较高熔点,可做耐火材料 | |
| B. | SO2能使溴水褪色,体现其漂白性 | |
| C. | 氨气是电解质,因为氨气的水溶液能导电 | |
| D. | 钠钾合金可用于快中子反应堆的热交换剂 |