题目内容
13. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
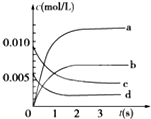
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
分析 (1)800℃,反应达到平衡时,NO的物质的量是0.007mol,由于容器的容积是2 L,根据c=$\frac{n}{V}$计算NO平衡浓度;
升高温度,NO的浓度增大,说明升高温度,平衡逆向移动,升高温度,平衡向吸热反应方向移动;
(2)在反应开始时c(NO)=0.01mol/L,在平衡时c(NO)=0.003 5 mol/L,△c(NO)=0.0065mol/L,根据反应方程式可知△c(NO2)=△c(NO);
根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.
解答 解:(1)800℃,反应达到平衡时,NO的物质的量是0.007mol,由于容器的容积是2 L,NO平衡浓度为$\frac{0.007mol}{2L}$=0.0035mol/L;
升高温度,NO的浓度增大,说明升高温度,平衡逆向移动,升高温度,平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应是放热反应,
故答案为:0.0035mol/L;放热;
(2)在反应开始时c(NO)=0.01mol/L,在平衡时c(NO)=0.003 5 mol/L,△c(NO)=0.0065mol/L,根据反应方程式可知△c(NO2)=△c(NO)=0.0065mol/L,故表示NO2的变化的曲线是b;
0~2s内v(NO)=$\frac{\frac{(0.02-0.008)mol}{2L}}{2s}$=0.003mol/(L•s),速率之比等于化学计量数之比,v(O2)=$\frac{1}{2}$v(NO)=0.0015mol/(L•s),
故答案为:b;0.0015mol/(L•s);
(3)a.若反应达到平衡,则v(NO2)正=2v(O2)逆,现在速率的正、逆为指明,因此不能判断反应是否达到平衡,故a错误;
b.由于该反应是反应前后气体体积不等的反应,所以若容器内压强保持不变,则反应达到平衡,故b正确;
c.v逆(NO)=2v正(O2),则NO、O2的浓度不变,反应达到平衡,故c正确;
d.因为反应是在体积固定的容器内进行的,无论反应是否发生,也无论反应是否达到平衡,容器内气体的密度都不变,因此不能作为判断平衡的标志,故d错误,
故选:bc.
点评 本题考查化学平衡计算、化学反应速率计算、化学平衡状态的判断、外界条件对化学平衡移动的影响的知识,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.

 阅读快车系列答案
阅读快车系列答案| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①、②中反应达平衡时XY3的平衡浓度相同 | |
| B. | 容器①、②中达到平衡时各物质的百分含量相同 | |
| C. | 达平衡时,两个容器中XY3的物质的量浓度均为2 mol•L-1 | |
| D. | 若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ |
R-OH+HBr?R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据如表;
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是b.
a.圆底烧瓶 b. 容量瓶 c.锥形瓶 d.量筒
(2)溴代烃的水溶性小于(填“大于”、“等于”或“小于”)相应的醇;其原因是醇分子可与水分子之间形成氢键,溴代烃不能与水分子之间形成氢键.
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的不正确的是a.
a. 水是反应的催化剂 b.减少Br2的生成 c.减少HBr的挥发 d.减少副产物烯和醚的生成
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其原因是平衡向生成溴乙烷的方向移动(或反应②向右移动);但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出.