题目内容
乙酸正丁酯是一种重要化工原料,某实验小组利用图1、图2装置合成乙酸正丁酯(夹持装置已略去),发生的化学反应为:
可能用到的有关数据见下表:
实验步骤如下:
①在图1的圆底烧瓶中,装入7.Og正丁醇和7.Og冰醋酸,再加入3-4滴浓硫酸。
②如图1所示,安装分水器和回流冷凝管。加热圆底烧瓶,待反应基本完成后,停止加誊
③冷却后将分水器中分出的酯层和圆底烧瓶中的反应液一起倒入分液漏斗中。先后用水、10%碳酸钠溶液洗涤。分离得到的酯层再用水洗涤后倒入锥形瓶中,加无水硫酸镁干燥。
④将干燥后的酯层倒入图2的蒸馏烧瓶中,加热蒸馏。收集124℃-126℃的馏分,称得质量为7.0g。
回答下列问题:
(1)图2冷凝管中冷水从____口流入(用字母表示);仪器d的名称是____。
(2)分液漏斗使用前须____并洗净备用。分离上下层液体时,应先____,然后打开活塞放出下层液体,上层液体从上口倒出。
(3)实验中产生的副产物的结构简式为____(任写一种)。用10%碳酸钠溶液洗涤的主要目的是____。
(4)实验中图1圆底烧瓶c的容积最适合的是____(选填字母)。
| A.25mL | B.50mL | C.250mL | D.500mL |
(6)实验中,乙酸正丁酯的产率为____%。
(1)b (1分) 尾接管 (1分)
(2)检漏 (1分) 打开分液漏斗上端的玻璃塞 (1分) (合理答案给分)
(3)CH3CH2CH=CH2 (2分) (合理答案给分) 除去醋酸、硫酸 (2分)
(4)B (1分)
(5)打开分水器下端的活塞,让水流出 (2分) 分水器中水面高度基本不再变化 (2分)
(6)63.8% (2分)
解析试题分析:(1)在蒸馏装置中,冷凝管中的冷凝水要下口进上口出,故选b;
(2)分液漏斗在使用时要振荡,故使用前必须检验是否漏水,分离液体时为使液体顺利流下,应先打开分液漏斗上端的玻璃塞
(3)在浓硫酸加热的条件下,正丁醇可以发生分子内脱水生成烯烃或分子脱水生成醚,合理即可
(4)在选择仪器装置时本着只大不小越接近越好的有原则,但在加热时,不能超过容器容积的1/2,故选择50mL比较合适
(6)乙酸正丁酯的理论产量是:
CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
60 74 116
7g 10.97g
所以实验中,乙酸正丁酯的产率为  ×100%=63.8%。
×100%=63.8%。
考点:考查有机化学实验

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案(12分)某实验小组用下列装置进行乙醇催化氧化的实验。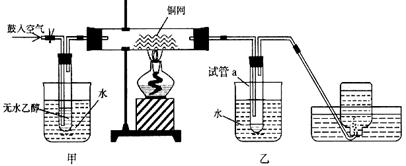
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式_________________。
(2)甲和乙两个水浴作用不相同,乙的作用是___________________。集气瓶中收集到的气体的主要成分是_____________________。
(3)若试管a中收集到的液体用紫色石蕊试纸,试纸显红色,说明液体中还有____________。要除去该物质,可先在混合液中加入_________(填写字母)。
| A.氯化钠溶液 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |
(4)实验一段时间后,将试管a中的液体取出,加入足量的银氨溶液,再放入甲烧杯中,很快出现明显的现象。写出该反应的化学方程式: ;反应类型为
已知某醇燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):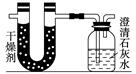
| | 实验前 | 实验后 |
| (干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
| (石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________ g,
假设广口瓶里生成一种正盐,其质量为________ g;
(2)生成的水中氢元素的质量为________ g;
(3)生成的二氧化碳中碳元素的质量为________ g;
(4)该燃料中碳元素与氢元素的质量比为________;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为__________,结构简式为_______________________________。
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| | 沸点/。c | 密度/(g·cm-3) | 水中溶解性 |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(3)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 。
(7)本实验中,正丁醛的产率为 %。
下列关于乙烯和聚乙烯的叙述不正确的是
| A.乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 |
| B.乙烯的化学性质比聚乙烯活泼 |
| C.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
| D.取等物质的量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的物质的量分别相等 |
某烃的结构简式为CH3CH(CH3)CH=C(C2H5)C≡CH,有关其分子结构的叙述正确的是
| A.分子中在同一直线上的碳原子数为4 | B.分子中在同一直线上的碳原子数为5 |
| C.分子中一定在同一平面上的碳原子数为6 | D.分子中在同一平面上的碳原子数最多为7 |

 、且属于酯类的同分异构
、且属于酯类的同分异构 。,
。, )也可以发生“Diels-Alder反应”,该化学反应方程式为:
)也可以发生“Diels-Alder反应”,该化学反应方程式为:
