题目内容
12.不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃).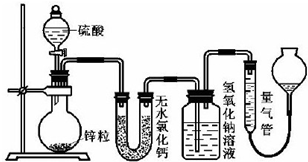
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是C.
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则圆底烧瓶中发生反应的化学方程式为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O.
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL气体,则有:ag/65g•mol-1=bg/64g•mol-1+V mL/22400mL•mol-1,依据的原理是得失电子守恒.
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反 应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,$\frac{n({H}_{2})}{n(S{O}_{2})}$=$\frac{64CV-2m}{m}$(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管,$\frac{n({H}_{2})}{n(S{O}_{2})}$的数值将偏小(填偏大、偏小或无影响)
(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①待冷却至室温才开始读数;
②读数前使量气管左右液面相平;
③视线与量气管中液面的凹液面最低点在同一水平面.
分析 (1)根据锌的质量计算生成气体的体积,从而确定量气管的适宜规格;
(2)根据氢氧化钠的性质分析增重的原因,并写出相应的化学反应方程式,分析装置中气体流向不能全部被吸收分析判断;
(3)根据氧化还原反应的特点分析,1 mol锌无论用来产生SO2 还是产生氢气都是1 mol锌对应1 mol气体;
(4)根据氢氧化钠洗气瓶增重的量求出反应的硫酸的物质的量,硫酸总量减去生成二氧化硫需要的硫酸的量即为生成氢气的硫酸的量,继而求出生成气体的物质的量;根据无水氯化钙的作用分析;
(5)①根据化学反应与反应热的关系分析;②根据溶液的读数方法分析;③视线的位置分析.
解答 解:(1)设生成的氢气为X
Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
$\frac{1.30g}{65g/mol}$ x
x=$\frac{1.30g}{65g/mol}$×22.4L=0.448L=448mL
故选C;
(2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,反应为Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,
故答案为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O;
(3)根据氧化还原知识或根据方程式,1 mol锌无论用来产生SO2 还是产生氢气都是1 mol锌对应1 mol气体,根据氧化还原反应中得失电子数相等列出式子,a g/65g•mol-1=b g/64g•mol-1+(V2-V1)ml/22400ml•mol-1,
故答案为:得失电子守恒;
(4)根据Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
2mol 1mol
$\frac{m}{32}$mol $\frac{m}{64}$mol
可知生成二氧化硫需要的硫酸为 $\frac{m}{32}$mol;
根据Zn+H2SO4=ZnSO4+H2↑,氢气的物质的量与锌的相同为(CV-$\frac{m}{32}$)mol,
$\frac{n({H}_{2})}{n(S{O}_{2})}$=$\frac{CV-\frac{m}{32}}{\frac{m}{64}}$=$\frac{64CV-2m}{m}$;
若撤走盛有无水氯化钙的U型管,混合气体中的水蒸气进入氢氧化钠溶液,导致洗气瓶增重量增大,所以计算时二氧化硫的物质的量增大,氢气与二氧化硫的物质的量之比偏小,
故答案为:$\frac{64CV-2m}{m}$;偏小;
(5)因为该反应是放热反应,随着反应的进行,溶液的温度逐渐升高,生成的气体温度高于标况下温度,温度对气体体积有影响,所以要待冷却至室温才开始读数;在读数时,如果俯视或仰视都会造成误差,所以读数时眼睛视线与液面最低处相平,
故答案为:①待冷却至室温才开始读数;②读数前使量气管左右液面相平;③视线与量气管中液面的凹液面最低点在同一水平面.
点评 本题考查性质实验方案的设计,涉及排气量气装置,要注意的是锌和硫酸的反应,硫酸浓度不同时,锌和硫酸反应的生成物不同,表现氧化性的元素也不同,题目难度中等.

| A. | 10mL、0.4mol/L的AlCl3溶液 | B. | 20mL、0.5mol/LCaCl2溶液 | ||
| C. | 30mL、1.5mol/L的KClO3溶液 | D. | 100mL、0.9mol/L的NaCl溶液 |
| A. | 硅溶于氢氧化钠溶液:Si+2OH-+H2O═SiO32-+2H2↑ | |
| B. | 碳酸氢镁中通入过量澄清石灰水:2HCO3-+2OH-+Mg2++Ca2+═CaCO3↓+MgCO3↓+2H2O | |
| C. | 浓硝酸与硫粉加热:S+4H++6NO3-$\frac{\underline{\;\;△\;\;}}{\;}$SO42-+6NO2↑+2H2O | |
| D. | 硫酸铝溶液不能与硫氢化钠溶液混溶的原因:Al3++3HS-+3H2O═3H2S↑+Al(OH)3↓ |
| A. | 同温同压下,相同体积的气体,它们的物质的量必相等 | |
| B. | 任何条件下,等体积的O2和H2O所含的分子数必相等 | |
| C. | 1LCO气体一定比1LO2的质量小 | |
| D. | 等质量的N2和CO2两种气体的分子数一定相等 |
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C的百分含量 ⑦各气体的物质的量 ⑧当有1molB气体分子断键,同时有1/2molC气体分子断键( )
| A. | ②③⑤⑥⑦⑧ | B. | ①②③⑥⑦⑧ | C. | ②③④⑤⑥⑧ | D. | ①③④⑤⑦ |
| A. | 纳米碳管是一种新型的高分子化合物 | |
| B. | 纳米碳管的化学性质稳定 | |
| C. | 纳米碳管的结构和性质与金刚石相同 | |
| D. | 纳米碳管导电属于化学变化 |