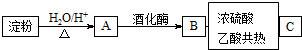题目内容
3.在KOH和KA1O2混合溶液中滴加稀盐酸直到过量,生成沉淀与所加盐酸体积关系的图象正确的是( )( )
| A. | 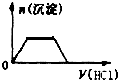 | B. | 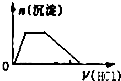 | C. | 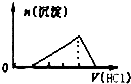 | D. |  |
分析 首先发生中和反应,没有沉淀产生,然后AlO2-+H++H2O=Al(OH)3↓,产生Al(OH)3沉淀,最后Al(OH)3 +3H+=Al3++3H2O,沉淀溶解,注意沉淀产生、沉淀溶解消耗的H+个数比是1:3.
解答 解:首先发生中和反应,没有沉淀产生,然后AlO2-+H++H2O=Al(OH)3↓,产生Al(OH)3沉淀,最后Al(OH)3 +3H+=Al3++3H2O,沉淀溶解,注意沉淀产生、沉淀溶解消耗的H+个数比是1:3;
A、开始无沉淀生成,图象不符合,故A错误;
B、依据分析可知,开始是中和反应,无沉淀生成,故B错误;
C、开始无沉淀生成,随后生成沉淀达到最大后沉淀溶解,但沉淀产生、沉淀溶解消耗的H+个数比是1:3,离子定量关系不符合,故C错误;
D、开始无沉淀生成,随后生成沉淀达到最大后沉淀溶解,沉淀产生、沉淀溶解消耗的H+个数比是1:3,离子定量关系符合,故D正确;
故选D.
点评 本题考查了铝及其化合物性质的分析判断,主要是图象曲线的变化,沉淀生成和溶解的定量关系分析,掌握反应实质和反应现象是解题关键,题目难度中等.

练习册系列答案
相关题目
13.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,48gO2和O3含有的氧原子数均为3NA | |
| B. | 常温常压下,11.2L乙烯含有2NA个碳原子 | |
| C. | 1.7g氨气所含有的电子数目为10NA | |
| D. | 2.7g铝与足量NaOH反应转移的电子数为NA |
14.实验室需要使用0.1mol/L的纯碱溶液100mL,下列操作或判断正确的是( )
| A. | 需要使用托盘天平称量Na2CO3•10H2O晶体2.86g | |
| B. | 将称量好的Na2CO3•10H2O晶体放入烧杯中,加入100mL蒸馏水,搅拌、溶解 | |
| C. | 转移溶液时应使用玻璃棒引流,且玻璃棒末端应靠在容量瓶刻度线下方 | |
| D. | 定容时,俯视刻度线会使所配制溶液的物质的量浓度偏低 |
18.A、B、C为短周期的三种元素,已知A、B处于同周期;A、C的最低价离子分别为A2-和C-;A2-的离子半径大于C-;B2+与C-具相同的电子层结构,以下叙述不正确的是( )
| A. | 原子半径B>A>C | B. | 原子序数A>B>C | ||
| C. | 离子半径A2->B2+>C- | D. | 最外层电子数C>A>B |
15.如图是初中化学常见的实验操作,其中错误的是( )
| A. |  给液体加热 | B. |  除去CO中的CO2 | C. |  称量 | D. |  稀释浓硫酸 |
6.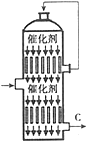 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
(1)以黄铁矿为原料生产SO2时反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉中进行(填设备名称);
(2)某科研小组测得某硫酸工厂生产工厂中SO2的平衡转化率与外部条件的关系如下表所示,则生产过程中,最适合的生产条件是1个大气压、400℃;
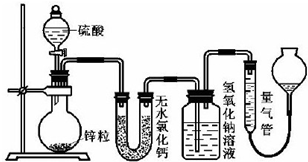
(3)接触室内有一热交换器,其作用是预热原料气,吸收反应放出的热量,若将从C处(如图)出来的气体通入BaCl2溶液中,则主要负电离子方程式为(写总反应式)SO3+Ba2++H2O=BaSO4↓+2H+;
(4)下列做法中,与提高硫酸工业的经济效益无关的是d;
a.适当地对黄铁矿进行粉碎
b.在接触室中使用适当过量的O2
c.利用生产中的余热发电或供暖
d.对废水进行无害化处理后再排放
(5)硫酸工业会产生许多对环境有害的物质,因此无论是工厂厂址的选择还是生产过程中有害成分的处理都要充分考虑环保的要求;
①某市计划建一个硫酸工厂,厂址有A、B、C三个地方可供选择,假设最终该厂建在B地,你认为选择B地建厂的理由是(至少回答两点)B地远离硫酸的消耗中心、B地远离人品稠密的地方;
②将尾气中SO2在一定条件下转化为CaSO4,然后利用焦炭将其转化为CaS(另有一种可燃性气体生成)具有重要的意义,写出CaSO4转化为CaS的化学方程式CaSO4+4C$\frac{\underline{\;高温\;}}{\;}$CaS+4CO;
(6)若用等质量的硫磺,FeS2生产硫酸,假设原料的总利用率均为90%,则二者得到的硫酸质量比为15:8.
 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.(1)以黄铁矿为原料生产SO2时反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉中进行(填设备名称);
(2)某科研小组测得某硫酸工厂生产工厂中SO2的平衡转化率与外部条件的关系如下表所示,则生产过程中,最适合的生产条件是1个大气压、400℃;
| 压强 (Pa) 温度 (℃) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
| 400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
| 500 | 96.75% | 97.67% | 98.52% | 98.94% |
| 600 | 85.20% | 88.97% | 92.76% | 94.68% |
(4)下列做法中,与提高硫酸工业的经济效益无关的是d;
a.适当地对黄铁矿进行粉碎
b.在接触室中使用适当过量的O2
c.利用生产中的余热发电或供暖
d.对废水进行无害化处理后再排放
(5)硫酸工业会产生许多对环境有害的物质,因此无论是工厂厂址的选择还是生产过程中有害成分的处理都要充分考虑环保的要求;
①某市计划建一个硫酸工厂,厂址有A、B、C三个地方可供选择,假设最终该厂建在B地,你认为选择B地建厂的理由是(至少回答两点)B地远离硫酸的消耗中心、B地远离人品稠密的地方;
②将尾气中SO2在一定条件下转化为CaSO4,然后利用焦炭将其转化为CaS(另有一种可燃性气体生成)具有重要的意义,写出CaSO4转化为CaS的化学方程式CaSO4+4C$\frac{\underline{\;高温\;}}{\;}$CaS+4CO;
(6)若用等质量的硫磺,FeS2生产硫酸,假设原料的总利用率均为90%,则二者得到的硫酸质量比为15:8.