题目内容
17.在一定温度下的恒容密闭容器中,当下列哪些量不再发生变化时,表明下述反应:A(s)+2B(g)=C(g)+D(g)已达到平衡状态:①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C的百分含量 ⑦各气体的物质的量 ⑧当有1molB气体分子断键,同时有1/2molC气体分子断键( )
| A. | ②③⑤⑥⑦⑧ | B. | ①②③⑥⑦⑧ | C. | ②③④⑤⑥⑧ | D. | ①③④⑤⑦ |
分析 反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断.
解答 解:①该反应是反应前后气体体积没有变化的反应,所以容器中的压强不再发生变化,不能证明达到了平衡状态,故①错误;
②该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量会变,所以当混合气体的密度不再发生变化时,能表明达到化学平衡状态,故②正确;
③反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的浓度等不再发生变化,所以各气体物质的物质的量浓度不再变化时,该反应达到平衡状态,故③正确;
④该反应是反应前后气体体积没有变化的反应,所以气体总物质的量不变,不能表明反应达到平衡状态,故④错误;
⑤该反应是反应前后气体体积没有变化的反应,所以气体总物质的量不变,根据质量守恒定律知,反应前后混合气体的质量会变,所以当混合气体的平均相对分子质量不再发生变化时,能表明达到化学平衡状态,故⑤正确;
⑥反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的浓度等不再发生变化,所以各气体物质的物质的量浓度不再变化时,所以物质C的百分含量不变,能表明达到化学平衡状态,故⑥正确;
⑦各气体的物质的量不变,则说明正逆反应速率相等,能表明达到化学平衡状态,故⑦正确;
⑧当有1molB断裂等效于$\frac{1}{2}$molC生成同时有$\frac{1}{2}$molC断裂,故⑧正确;
故选A.
点评 本题考查化学平衡状态的判断,难度不大,注意只有反应前后不相同的量才能作为判断化学平衡的依据,反应前后不改变的量不能作为判断化学平衡的依据,如该反应中的压强就不能作为判断化学平衡的依据.

练习册系列答案
相关题目
7.下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 经过打磨的铝片投入盐酸中 | 气泡冒出速率由快到慢 | Cl-起到催化作用 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将NH3通过灼热的氧化铜固体 | 固体变红 | 氨气具有还原性 |
| D | 用火柴点燃浸泡过硅酸钠溶液的滤纸 | 未燃烧 | 硅酸钠隔绝了空气 |
| A. | A | B. | B | C. | C | D. | D |
2.在下列反应中能置换出铜的是( )
①Na+CuSO4(溶液)②CuO+CO(加热)③CuO+H2(加热)④Fe+CuSO4(溶液)
①Na+CuSO4(溶液)②CuO+CO(加热)③CuO+H2(加热)④Fe+CuSO4(溶液)
| A. | ①②③④ | B. | ②③ | C. | ③④ | D. | ①④ |
9.0.001mol/L的盐酸中滴入甲基橙,溶液显( )
| A. | 红色 | B. | 橙色 | C. | 黄色 | D. | 无法判断 |
6.要使在密闭容器中进行的可逆反应2A(g)+B(s)?2C(g)的正反应速率加快,可采取的措施是( )
| A. | 恒压下充N2 | B. | 加B | C. | 恒容下充N2 | D. | 加A |
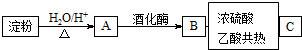
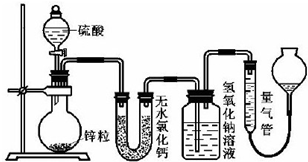
 ,该化合物中含有的化学键有离子键、共价键
,该化合物中含有的化学键有离子键、共价键