题目内容
14.如图1-4是各个原子的性质和原子序数(1~20)的关系图,各图的纵轴可能代表下列的某一性质:质量数、质子数、中子数、最高正价、原子半径相对大小、得电子相对能力.图3中原子序数8、9和图4中原子序数2、10、18在纵轴上没有对应的数值.
(1)图1~图4的纵轴分别代表质子数、中子数、最高正价、得电子相对能力.
(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中.B是生命体的构架元素,E是同周期中半径最小的元素,G的最高价含氧酸的产量是衡量一个国家化工实力的标志.它们的原子序数存在如下关系:a+b=c,$\frac{b+d}{2}$=c,$\frac{e+c}{2}$=d,请根据提供的信息,回答下列问题:
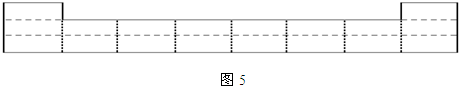
①图5是元素周期表前三周期的边界,请将A~G六种具体元素符号填在表中相应的位置.
②写出铜与上述某一元素最高价氧化物对应水化物反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O(任写一个即可).
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y-→Z+W.若X为单质,Y、Z、W均为化合物,其相应的化学方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O或4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O或2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O;若X、Y、Z、W均为化合物,其相应的化学方程式为3NO2+H2O═2HNO3+NO或SO2+NO2═SO3+NO(任写一个,合理即可).
分析 (1)元素的质子数等于该元素的原子序数;原子中中子数与与质子数相近;元素的最高正价等于最外层电子数,且O、F无最高正价,稀有气体化合价为0;从图4中,可以发现元素原子的某种性质随原子序数的递增而呈周期性变化(小→大);
(2)aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中,B是生命体的构架元素,则B为C,即b=6,G的最高价含氧酸的产量是衡量一个国家化工实力的标志,则G为S,E的原子序数小于G大于B,且E是同周期中半径最小的元素,所以E为F,即e=9,原子序数存在如下关系:①a+b=c,②$\frac{b+d}{2}$=c,③$\frac{e+c}{2}$=d,将①×3-②×2-③可得3a+b=e,所以a=1,即A为H,再用代入法,根据①式可得c=7,根据②式可得d=8,所以C为N,D为O,
①由题意知,A为H,B为C,C为N,D为O,E为F,G为S.依据元素周期表的结构,把具体的元素符号填入周期表中.
②上述元素最高价氧化物对应的水化物能与铜反应的是浓硫酸和硝酸.
③本问为开放式问题,符合的化学反应方程式特别多,书写时可采用逐族排查无机反应和分类考虑有机反应的方法.
解答 解:(1)元素的质子数等于该元素的原子序数,故图1纵轴代表质子数;原子中中子数与与质子数相近,故图2纵轴代表中子数;元素的最高正价等于最外层电子数,且O、F无最高正价,稀有气体化合价为0,故图3纵轴代表最高正价;从图4中,可以发现元素原子的某种性质随原子序数的递增而呈周期性变化(小→大),故图4纵轴代表得电子相对能力,
故答案为:质子数;中子数;最高正价;得电子相对能力;
(2)①依据元素周期表的结构及元素原子的结构,把具体的元素符号填入周期表中为: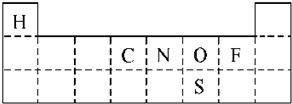 ,
,
故答案为: ;
;
②C元素最高价氧化物对应的水化物的浓溶液为浓HNO3,铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O或C元素最高价氧化物对应的水化物的浓溶液为浓H2SO4,铜与浓H2SO4反应生成硫酸铜、二氧化硫与水,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y-→Z+W,X为单质,Y、Z、W均为化合物,该反应可以用甲烷与氧气反应或氨的催化氧化或硫化氢与氧气的反应,反应方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O或4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O或2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,若X、Y、Z、W均为化合物,对应的反应可以为二氧化氮与水的反应或二氧化氮与二氧化硫的反应,反应的化学方程式为3NO2+H2O═2HNO3+NO或SO2+NO2═SO3+NO,
故答案为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O或4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O或2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O;3NO2+H2O═2HNO3+NO或SO2+NO2═SO3+NO;
点评 本题考查结构性质位置关系综合运用,难度中等,(1)注意根据元素周期律分析图象中纵坐标随横坐标的变化关系.

| A. | 普通玻璃的主要成分是纯碱、石灰石和二氧化硅 | |
| B. | “光化学烟雾”与碳氢化合物和氮氧化合物的大量排放有关 | |
| C. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| D. | C、S分别在空气中燃烧均可得到两种不同的氧化物 |
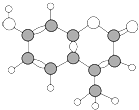 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( ) ①分子式为C10H9O3
②不能溶于水
③1mol该物质最多能与4molH2加成
④能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含2mol NaOH的溶液反应.
| A. | ①②③ | B. | ③④⑤ | C. | ②③④ | D. | ②③④⑤ |
| ﹨ | a | b | c | d |
| a | ﹨ | ↓ | ↑ | - |
| b | ↓ | ﹨ | ↓ | ↓ |
| c | ↑ | ↓ | ﹨ | - |
| d | - | ↓ | - | ﹨ |
| A. | c一定是稀硫酸 | B. | d一定是MgCl2溶液 | ||
| C. | a可能是NaHCO3溶液 | D. | b一定是Ba(OH)2溶液 |
| A. | 硫酸氢铵和氢氧化钠等物质的量混合 NH4++OH-═NH3↑+H2O | |
| B. | 碳酸氢钙与过量氢氧化钙溶液反应:Ca2++HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 实验室浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
| A. | 向BaCl2溶液中通入SO2气体,先有白色沉淀,后沉淀消失 | |
| B. | CCl4和NH3两分子中各原子最外层均满足8电子结构 | |
| C. | 若短周期元素R2+和M+的电子层结构相同,则金属性R>M | |
| D. | 标准状况下,11.2 LN2和O2的混合气所含原子总数约为6.02×1023 |
①浓氨水 ②氯水 ③硝酸银 ④浓硝酸 ⑤浓盐酸 ⑥溴化银.
| A. | ①②③④⑤⑥ | B. | ②③④⑥ | C. | ②③⑤⑥ | D. | ①③④⑥ |
 A、B、C、D、E五种短周期元素,它们的原子序数依次增大,B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零,D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$-n,请回答下列问题:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大,B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零,D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$-n,请回答下列问题: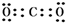 .
.
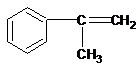 .
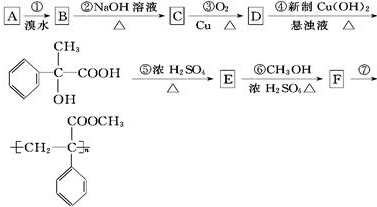
. +Br2→
+Br2→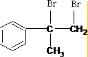 ;E→F
;E→F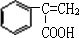 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$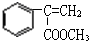 +H2O.
+H2O. .
.