题目内容
11.在一定的温度下,一定量的水中,Ca(OH)2悬浊液中存在如下平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),当向混合物中加入少量CaO粉末时,下列说法正确的是( )| A. | Ca2+数目减少 | B. | Ca2+浓度增大 | ||
| C. | 溶液的pH增大 | D. | Ca(OH)2固体质量不变 |
分析 向悬浊液中加少量CaO,发生反应:CaO+H2O=Ca(OH)2,反应消耗水,溶液中c(Ca2+)、c(OH-)增大,由于原溶液已达到饱和,则沉淀溶解平衡向逆反应方向移动,Ca(OH)2固体的质量变大,故各离子的浓度减小;达到新的平衡,但是饱和溶液的浓度只与温度有关,故钙离子、氢氧根离子的浓度保持不变.
解答 解:向悬浊液中加少量CaO,发生反应:CaO+H2O=Ca(OH)2,溶液中c(Ca2+)、c(OH-)增大,由于原溶液已达到饱和,则沉淀溶解平衡向逆反应方向移动,Ca(OH)2固体的质量变大,
A.反应后仍为饱和溶液,溶液中c(Ca2+)不变,由于溶液体积减小,则溶液中钙离子数目减少,故A正确;
B.反应后溶液为饱和溶液,溶液中c(Ca2+)不变,故B错误;
C.反应后仍为饱和溶液,溶液中的c(OH-)不变,则溶液pH不变,故C错误;
D.根据分析可知,反应后Ca(OH)2固体的质量变大,故D错误;
故选A.
点评 本题考查难溶电解质的溶解平衡及其影响,题目难度中等,注意明确向悬浊液中加少量CaO,发生的反应CaO+H2O=Ca(OH)2,溶液体积减小,则溶解平衡向着逆向移动,氢氧化钙的质量增大,但溶液中钙离子、氢氧根离子浓度不变.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
6.下列离子方程式正确的是( )
| A. | 硫酸氢铵和氢氧化钠等物质的量混合 NH4++OH-═NH3↑+H2O | |
| B. | 碳酸氢钙与过量氢氧化钙溶液反应:Ca2++HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 实验室浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
16.“沙林”是剧毒的神经毒气,其结构简式为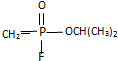 .已知
.已知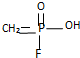 的名称为甲氟磷酸,则“沙林”的化学名称为( )
的名称为甲氟磷酸,则“沙林”的化学名称为( )
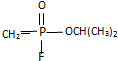 .已知
.已知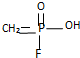 的名称为甲氟磷酸,则“沙林”的化学名称为( )
的名称为甲氟磷酸,则“沙林”的化学名称为( )| A. | 甲氟磷酸异丙醚 | B. | 甲氟磷酸异丙酯 | ||
| C. | 甲基异丙基氟磷酸 | D. | 甲氟异丙氧基磷酸 |
3.下列叙述正确的是( )
| A. | 向BaCl2溶液中通入SO2气体,先有白色沉淀,后沉淀消失 | |
| B. | CCl4和NH3两分子中各原子最外层均满足8电子结构 | |
| C. | 若短周期元素R2+和M+的电子层结构相同,则金属性R>M | |
| D. | 标准状况下,11.2 LN2和O2的混合气所含原子总数约为6.02×1023 |
20.下列化学用语表示正确的是( )
| A. | 钾原子结构示意图: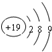 | B. | CCl4的电子式: | ||
| C. | HClO的结构式:H-Cl-O | D. | MgCl2的电子式: |
1.下列有关卤族元素的叙述不正确的是( )
| A. | 卤族元素从F到I,其气态氢化物的稳定性逐渐减弱,HX水溶液酸性逐渐增强 | |
| B. | 卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX的熔沸点:HF>HI>HBr>HCl | |
| D. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 |
 A、B、C、D、E五种短周期元素,它们的原子序数依次增大,B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零,D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$-n,请回答下列问题:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大,B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零,D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$-n,请回答下列问题: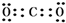 .
.
 .
. +Br2→
+Br2→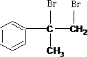 ;E→F
;E→F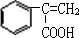 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
.