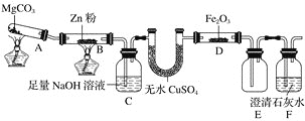
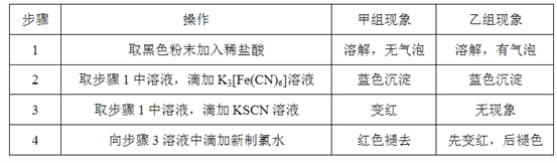
题目内容
【题目】我国政府为消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾,现实验室需要配制480mL 0.1mol/LKIO3溶液,实际操作步骤有:
(1)需称量碘酸钾的质量为___g。
(2)配制溶液时下列仪器中:
A.锥形瓶 B.托盘天平 C.烧杯 D.胶头滴管 E.药匙 F.量筒
不需要用到的是__(填序号),尚缺的玻璃仪器有___和___(写名称)。
(3)人们常将配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移 H.装入试剂瓶
其正确的操作顺序应是___(填序号)。
①B E A G C G D F H ②B E G A C G F D H
③B E F G C G D H A ④B E A G C G D H F
(4)在此配制过程中,下列情况会使配制结果偏高的是____ (填序号)。
①转移时未洗涤烧杯和玻璃棒 ②定容时俯视刻度线观察液面
③定容时仰视刻度线观察液面 ④容量瓶用蒸馏水洗干净后未干燥
⑤摇匀后静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(5)检验食盐中是否加碘,可利用如下反应:KIO3+KI+H2SO4─ K2SO4+I2+H2O(未配平)
①配平该方程式,并且用双线桥法表示该方程式电子转移的方向和数目:___。
②该反应中氧化剂和还原剂的物质的量之比为___。
③如果反应中转移0.5mol电子,则生成I2的物质的量为____mol
【答案】10.7 A F 玻璃棒 500ml容量瓶 ① ②  1:5 0.3
1:5 0.3
【解析】
(1)实验室没有480mL容量瓶,需选择500mL的容量瓶,计算时溶液按500mL计算。需称量碘酸钾的质量为0.1mol/L×0.5L×214g/mol。
(2)配制溶液时下列仪器中:
A.锥形瓶 B.托盘天平 C.烧杯 D.胶头滴管 E.药匙 F.量筒
不需要用到的是锥形瓶和量筒,尚缺的玻璃仪器有玻璃棒和500mL容量瓶。
(3)将配制过程中正确的操作顺序应从计算、称量、溶解、转移、定容五个方面确定八个步骤的顺序。
(4)分析误差时,从![]() 入手进行:
入手进行:
①转移时未洗涤烧杯和玻璃棒,n偏小,c偏小;
②定容时俯视刻度线观察液面,V偏小,c偏大;
③定容时仰视刻度线观察液面,V偏大,c偏小;
④容量瓶用蒸馏水洗干净后未干燥,n不变,c不变;
⑤摇匀后静置,发现液面低于刻度线,再加蒸馏水补至刻度线,V偏大,c偏小。
(5)检验食盐中是否加碘,可利用如下反应:KIO3+KI+H2SO4─ K2SO4+I2+H2O(未配平)
①配平时,先配氧化剂和还原剂,KIO3+5KI─ 3I2;再按质量守恒配平,KIO3+5KI+3H2SO4= 3K2SO4+3I2+3H2O;
双线桥法表示该方程式电子转移的方向和数目: 
②该反应中氧化剂是KIO3、还原剂是KI,从方程式中可以看出二者的物质的量之比。
③转移电子与I2的关系式为 5e-——3I2,由反应中转移0.5mol电子,可求出生成I2的物质的量。
(1)实验室没有480mL容量瓶,需选择500mL的容量瓶,计算时溶液按500mL计算。需称量碘酸钾的质量为0.1mol/L×0.5L×214g/mol=10.7g;答案为:10.7;
(2)配制溶液时下列仪器中:
A.锥形瓶 B.托盘天平 C.烧杯 D.胶头滴管 E.药匙 F.量筒
不需要用到的是锥形瓶和量筒,尚缺的玻璃仪器有玻璃棒和500mL容量瓶;答案为:A F;玻璃棒;500ml容量瓶;
(3)将配制过程中正确的操作顺序应从计算、称量、溶解、转移、定容五个方面确定八个步骤的顺序为B E A G C G D F H;答案为:①;
(4)分析误差时,从![]() 入手进行:
入手进行:
①转移时未洗涤烧杯和玻璃棒,n偏小,c偏小;
②定容时俯视刻度线观察液面,V偏小,c偏大;
③定容时仰视刻度线观察液面,V偏大,c偏小;
④容量瓶用蒸馏水洗干净后未干燥,n不变,c不变;
⑤摇匀后静置,发现液面低于刻度线,再加蒸馏水补至刻度线,V偏大,c偏小。
综合以上分析,使配制结果偏高的是②;答案为:②;
(5)检验食盐中是否加碘,可利用如下反应:KIO3+KI+H2SO4─ K2SO4+I2+H2O(未配平)
①配平时,先配氧化剂和还原剂,KIO3+5KI─ 3I2;再按质量守恒配平,KIO3+5KI+3H2SO4= 3K2SO4+3I2+3H2O;
双线桥法表示该方程式电子转移的方向和数目:  ;答案为:KIO3+5KI+3H2SO4= 3K2SO4+3I2+3H2O;
;答案为:KIO3+5KI+3H2SO4= 3K2SO4+3I2+3H2O; ;
;
②该反应中氧化剂是KIO3、还原剂是KI,从方程式中可以看出二者物质的量之比1:5;
③转移电子与I2的关系式为 5e-——3I2,由反应中转移0.5mol电子,可求出生成I2的物质的量0.3mol。
答案为:1:5;0.3。

【题目】常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液②NaOH溶液③CH3COONa溶液④Na2CO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH由大到小的顺序是_______(填序号)。
(2)NaCN溶液显碱性的原因(用方程式说明)______
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____④(填“>”、“<"、“=”)。
(4)25℃时,将amol·L-1 的醋酸和 0.1 mol·L-lNaOH溶液等体积混合后,溶液的pH=7,则a_____0.1(填“﹥”、“﹤”或“=”)。
(5)Na2CO3溶液中离子浓度大小为:___________
(6)向NaCN溶液中通入CH3COOH,则发生的离子反应方程式为:_______。
(7)同温下,溶液的pH值④____①(填“>”、“<"、“=”)。