题目内容
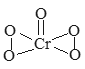
【题目】已知过氧化铬(CrO5)的结构式如下图所示,过氧化铬不稳定,溶于水生成过氧铬酸;溶于酸生成铬(III)盐(绿色)并放出氧气,反应方程式为:4CrO5+12H+=4Cr3++7O2+6H2O)。下列有关说法正确的是( )
A. CrO5中Cr元素的化合价为+10
B. 过氧化铬中含有极性共价键、非极性共价键和离子键
C. 过氧化铬具有较强的氧化性
D. 上述反应每转移0.2mol电子就能生成2.24LO2
【答案】C
【解析】
A. CrO5中存在过氧键、Cr-O键、Cr=O键;
B.不同非金属元素之间易形成极性键;
C. CrO5能和水反应生成酸,和酸反应生成铬酸盐和氧气;
D.温度和压强未知,无法计算氧气的物质的量。
A. CrO5中存在2个过氧键、1个Cr=O键,所以4个O原子显-1价、1个O原子显-2价,所以Cr元素显+6价,故A错误;
B.不同非金属元素之间易形成极性键,所以CrO5中不存在极性键,故B错误;
C. CrO5能和水反应生成酸,所以为酸性氧化物,和酸反应生成铬酸盐和氧气,Cr元素化合价由+6价变为+3价,所以CrO5具有较强的氧化性,所以C选项是正确的;
D.温度和压强未知,无法计算氧气的物质的量,导致无法计算转移电子的物质的量,故D错误。
所以C选项是正确的。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】实验室用绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质性质如下:
甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
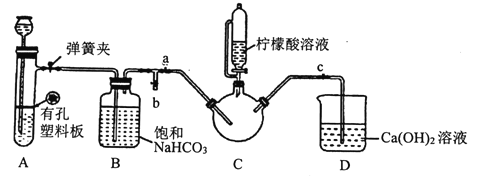
III.制备(H2NCH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为____(写化学式)。
(2)实验II中:生成沉淀的离子方程式为________________。
(3)实验III中:
①检查装置A的气密性的方法是_________。
②装置A中所盛放的药品是_______ (填序号)。
a.Na2CO3和稀H2SO4 b.CaCO3和稀H2SO4 c.CaCO3和稀盐酸
③确认c中空气排尽的实验现象是______________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是_______。
⑤洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是___(填序号)。
a.热水 b.乙醇溶液 c.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为_____。