题目内容
【题目】在下列反应中,二氧化碳作氧化剂的是( )
A.Ca(OH)2+CO2=CaCO3↓+H2O
B.CO2+C![]() 2CO
2CO
C.2Fe2O3+3C![]() 4Fe+3CO2↑
4Fe+3CO2↑
D.C+2H2O(g)![]() 2H2+CO2
2H2+CO2
【答案】B
【解析】
A. Ca(OH)2+CO2=CaCO3↓+H2O反应中,没有元素化合价的变化,不是氧化还原反应,A错误;
B. CO2+C![]() 2CO反应,CO2中C元素的化合价降低,则CO2为氧化剂,B正确;
2CO反应,CO2中C元素的化合价降低,则CO2为氧化剂,B正确;
C. 2Fe2O3+3C![]() 4Fe+3CO2↑中C元素的化合价升高,则C为还原剂,CO2为氧化产物,C.错误;
4Fe+3CO2↑中C元素的化合价升高,则C为还原剂,CO2为氧化产物,C.错误;
D.C+2H2O(g)![]() 2H2+CO2反应中,C元素的化合价升高,则C为还原剂,CO2为氧化产物,D错误;
2H2+CO2反应中,C元素的化合价升高,则C为还原剂,CO2为氧化产物,D错误;
故合理选项是B。

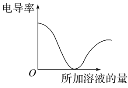
【题目】常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液②NaOH溶液③CH3COONa溶液④Na2CO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH由大到小的顺序是_______(填序号)。
(2)NaCN溶液显碱性的原因(用方程式说明)______
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____④(填“>”、“<"、“=”)。
(4)25℃时,将amol·L-1 的醋酸和 0.1 mol·L-lNaOH溶液等体积混合后,溶液的pH=7,则a_____0.1(填“﹥”、“﹤”或“=”)。
(5)Na2CO3溶液中离子浓度大小为:___________
(6)向NaCN溶液中通入CH3COOH,则发生的离子反应方程式为:_______。
(7)同温下,溶液的pH值④____①(填“>”、“<"、“=”)。
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
序号 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na > Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca > Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br > I |
A. AB. BC. CD. D