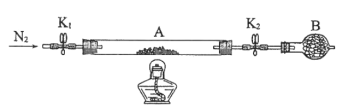
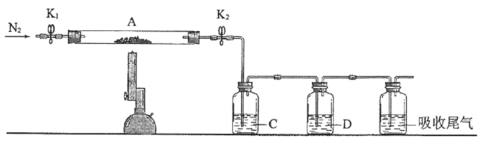
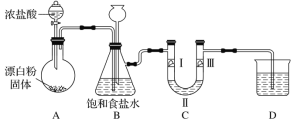
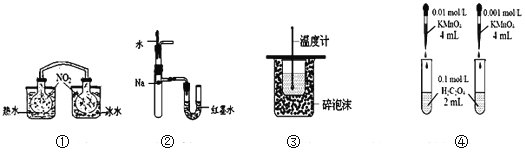
题目内容
【题目】常温下,将![]() mL 1mo/L
mL 1mo/L ![]() 和
和![]() mL 1mo/L
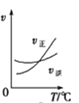
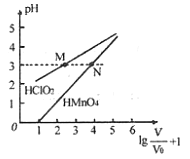
mL 1mo/L ![]() 两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
A. ![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B. 在0≤pH≤5时,![]() 溶液满足
溶液满足![]()
C. 分别往M、N两点对应溶液中滴加1 mo/L NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等
D. 常温下,浓度均为0.1 mo/L的![]() 和
和![]() 溶液,溶液pH:
溶液,溶液pH:![]() >
>![]()
【答案】C
【解析】
A、由图可知,1mo/LHClO2溶液的pH>1, 1mo/LHMnO4的pH=0,说明HClO2是弱酸,HMnO4为强酸,故A错误;
B、根据图像可知:因为HClO2为弱酸,稀释促进电离,不能满足满足0≤pH≤5时,溶液的pH与溶液体积稀释的关系pH=![]() ,HMnO4是强酸能满足满足0≤pH≤5时,溶液的pH与溶液体积稀释的关系pH=
,HMnO4是强酸能满足满足0≤pH≤5时,溶液的pH与溶液体积稀释的关系pH=![]() ,故B错误;
,故B错误;
C、同体积同浓度中和1mol·L-1的NaOH溶液能力相同,故C正确;
D、酸性:HClO2<HMnO4,同浓度的NaClO2水解显碱性,pH>7,NaMnO4溶液不水解显中性;故D错误。
正确答案选C。

【题目】常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液②NaOH溶液③CH3COONa溶液④Na2CO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH由大到小的顺序是_______(填序号)。
(2)NaCN溶液显碱性的原因(用方程式说明)______
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____④(填“>”、“<"、“=”)。
(4)25℃时,将amol·L-1 的醋酸和 0.1 mol·L-lNaOH溶液等体积混合后,溶液的pH=7,则a_____0.1(填“﹥”、“﹤”或“=”)。
(5)Na2CO3溶液中离子浓度大小为:___________
(6)向NaCN溶液中通入CH3COOH,则发生的离子反应方程式为:_______。
(7)同温下,溶液的pH值④____①(填“>”、“<"、“=”)。