题目内容
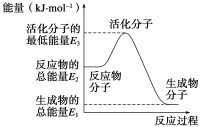
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+NO(g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2 min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2 min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/(mol·L-1) | 0.10 | 0.20 | 0.20 |
c(SO2)/(mol·L-1) | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2 min的平均速率v(SO2)=0.10 mol·L-1·min-1
B. 达到平衡时,容器丙中正反应速率与容器甲相等
C. 温度升至90℃,上述反应平衡常数为1.56,则反应的ΔH>0
D. 容器乙中若起始时改充0.10 mol·L-1NO2和0.20 mol·L-1SO2,达到平衡时c(NO)与原平衡相同
【答案】C
【解析】
A.容器甲中的反应在2min的平均速率v(SO2)=0.10![]() /2=0.025 mol·L-1·min-1,故A错误;B.反应NO2(g)+SO2(g)
/2=0.025 mol·L-1·min-1,故A错误;B.反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)为气体体积不变的反应,压强不影响平衡,则容器甲和丙互为等效平衡,平衡时反应物转化率相等,因为丙中各组分浓度为甲的2倍,则容器丙中的反应速率较大,故B错误;C.温度升至90℃,上述反应平衡常数为1.56>1,则升高温度平衡向正反应方向移动,则正反应为吸热反应,该反应的ΔH>0,所以C选项是正确的;D.令平衡时NO的浓度为ymol/L,则:
SO3(g)+NO(g)为气体体积不变的反应,压强不影响平衡,则容器甲和丙互为等效平衡,平衡时反应物转化率相等,因为丙中各组分浓度为甲的2倍,则容器丙中的反应速率较大,故B错误;C.温度升至90℃,上述反应平衡常数为1.56>1,则升高温度平衡向正反应方向移动,则正反应为吸热反应,该反应的ΔH>0,所以C选项是正确的;D.令平衡时NO的浓度为ymol/L,则:
NO2(g)+SO2(g) ![]() SO3(g)+ NO(g)
SO3(g)+ NO(g)
开始(mol·L-1) 0.1 0.2 0 0
转化(mol·L-1) y y y y
平衡(mol·L-1)0.1-y 0.2-y y y
则y![]() /(0.1-y)
/(0.1-y)![]() (0.2-y)=1,只要二氧化氮和二氧化硫的浓度分别是0.10 mol·L-1NO2和0.20 mol·L-1SO2,平衡时NO的浓度不相同,所以D错误.答案:C。
(0.2-y)=1,只要二氧化氮和二氧化硫的浓度分别是0.10 mol·L-1NO2和0.20 mol·L-1SO2,平衡时NO的浓度不相同,所以D错误.答案:C。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验装置示意图、实验现象及结论均正确的是
A | B | |
实验 |
|
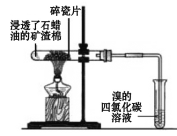
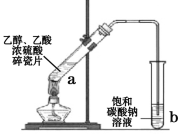
|
现象 | 溴的四氯化碳溶液褪色 | 试管b中出现分层现象 |
结论 | 石蜡油分解产物中仅含有烯烃 | 反应生成难溶于饱和碳酸钠溶液的乙酸乙酯 |
C | D | |
实验 |
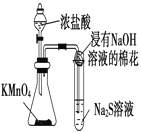
|
|
现象 | 试管中有淡黄色沉淀产生 | 反应过程中钠未熔化成小球 |
结论 | 非金属性Cl>S | 反应吸热 |
A. AB. BC. CD. D