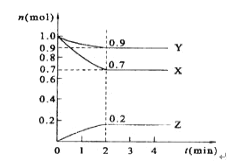
题目内容
【题目】下列与阿伏加德罗常数的值( NA)有关的说法正确的是
A. 在标准状况下,2.24L水中含有氢原子的数目为2NA
B. 8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA
C. 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后可得到NH3分子数为NA
D. 2.3 g Na与氧气完全反应,反应中转移的电子数在0.1NA~0.2NA之间
【答案】B
【解析】
A.在标准状况下,水是液态,所以2.24L水不是0.1mol,氢原子数不是2NA,故A错误;
B.8g Cu2S的物质的量为:n(Cu2S)=![]() =0.05mol,n(Cu)=2
=0.05mol,n(Cu)=2![]() 0.05mol=0.1mol;8gCuO的物质的量为:n(CuO)=
0.05mol=0.1mol;8gCuO的物质的量为:n(CuO)=![]() =0.1mol,n(Cu)=1
=0.1mol,n(Cu)=1![]() 0.1mol=0.1mol,两种物质含有铜原子数都是0.1NA,故B正确;
0.1mol=0.1mol,两种物质含有铜原子数都是0.1NA,故B正确;
C.在密闭容器中加入0.5 mol N2和1.5 mol H2,发生合成氨反应,此反应是可逆反应,不能进行到底, 生成的NH3少于0.1mol,得到的NH3分子少于0.1NA,故C错误;
D.Na与氧气完全反应,无论生成Na2O还是Na2O2,Na的化合价都是0![]() +1,所以,2.3 g Na与氧气完全反应,反应中转移的电子数一定是0.1NA,故D错误;
+1,所以,2.3 g Na与氧气完全反应,反应中转移的电子数一定是0.1NA,故D错误;
本题答案为B。

【题目】化学课外活动小组利用以下装置完成系列实验.请回答以下问题:
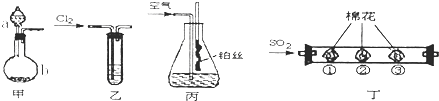
(1)装置甲中仪器a的名称为___ . 用装置甲制取NH3 , 在b中加入CaO固体,a中加入浓氨水,写出反应的化学方程式:___ .
(2)将C12持续通入装有淀粉一KI无色溶液的装置乙中,溶液变蓝而后逐渐褪色.查阅资料得知:溶液蓝色逐渐褪色,是因为有+5价的碘元素生成.请写出该反应的离子方程式:___ .
(3)用装置丙模拟“氨的催化氧化”实验.锥形瓶内装有浓氨水,通入空气,并将红热的铂丝插入锥形瓶内,铂丝保持红热.铂丝保持红热的原因是___;锥形瓶内还可观察到现象是___ .
(4)活动小组从“绿色化学”角度出发.在装置丁中进 行SO2的性质实验.其中棉花上蘸有不同试剂.请填写表中空白:
棉花位置 | ① | ② | ③ |
棉花上蘸有的试剂 | 品红溶液 | 酸性高锰酸钾溶液 | ___ |
现象 | ___ | 溶液紫色褪去 | 无 |
结论 | SO2具有漂白性 | SO2具有___ | SO2有毒,不能排空 |