题目内容
下列离子方程式正确的是
| A.醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+ |
| C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
B
解析试题分析:A、不正确,CaCO3+2CH3COOH=Ca2++2CH3COO―+H2O+CO2↑;B、正确;C、不正确,2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;D、不正确,条件是强碱,方程式中却写出的是酸性条件。选B。
考点:离子方程式判断正误

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
甲、乙、丙、丁四种易溶于水的物质,分别由Na+、Ba2+、Al3+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,已知:①0.1 mol/L甲溶液中c(H+)>0.1 mol/L;②将少量乙溶液分别滴入其他三种物质的溶液时,均有白色沉淀生成;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,下列判断正确的是
| A.甲溶液含有SO42- | B.乙溶液含有SO42- |
| C.丙溶液显酸性 | D.丁溶液显酸性 |
下列离子方程式正确的是
| A.在碳酸氢钙溶液中加入少量盐酸:Ca2++2HCO3-+2H+→CO2↑+2H2O+CaCO3↓ |
| B.硫酸铁溶液与氢氧化钡溶液:Fe3++SO42-+Ba2++3OH-→Fe(OH)3↓+BaSO4↓ |
| C.次氯酸钙溶液中通入足量二氧化硫:Ca2++ClO-+SO2+H2O→CaSO4↓+Cl-+2H+ |
| D.氢氧化钠溶液中通入过量二氧化碳:OH-+CO2→HCO3- |
某中性含 Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的一种或几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色溶液中加入BaCl2溶液时,无沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定不存在的离子是
| A.NH4+、Br-、CO32- | B.NH4+、I-、SO32- |
| C.Fe2+、I-、SO32- | D.Fe2+、CO32-、I- |
下列微粒在溶液中能大量共存,通入SO2后仍能大量共存的一组是
| A.Ba2+、Na+、H+、Cl- | B.Na+、K+、SO32-、Cl- |
| C.Al3+、K+、Br-、HCO3- | D.Fe3+、Na+、H2O2、SO42- |
下列表示对应化学反应的离子方程式正确的是
| A.用白醋除铁锈:Fe2O3+6H+ = 3H2O + 2Fe3+ |
| B.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热: Ba2+ +2OH-+ NH4+ + HCO3-  NH3↑+2H2O+BaCO3↓ NH3↑+2H2O+BaCO3↓ |
| C.用过量冷氨水吸收SO2: SO2+NH3·H2O=HSO3-+NH4+ |
| D.用强碱吸收工业制取硝酸尾气: NO+NO2+2OH-=2NO3-+H2O |
下列离子或分子在溶液中能大量共存,加入足量Na2O2后仍能大量共存的是
| A.K+、Cl-、Na+、SO32- | B.Ba2+、NO3-、Al3+、Br- |
| C.K+、NH4+、I-、CO32- | D.Na+、Cu2+、NH3·H2O、SO42- |
下列表示对应化学反应的离子方程式错误的是
| A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+6H+=3I2+3H2O |
| B.向甲酸溶液中加入KOH溶液:HCOOH+OH-=HCOO-+H2O |
| C.将过量CO2通入冷氨水中:CO2+NH3?H2O=HCO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
下列离子方程式书写正确的是
| A.向碳酸钠溶液中滴加与其溶质的物质的量相等的盐酸:CO32-+2H+= CO2↑+ H2O |
B.向苯酚钠溶液中通入少量的CO2: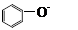 + CO2 +H2O→ + CO2 +H2O→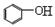 + HCO3- + HCO3- |
| C.足量铁粉与稀硝酸反应:Fe+4H++NO3-=Fe3++2H2O+NO↑ |
| D.向漂白粉溶液中通入少量二氧化硫: Ca2+ +2ClO- + SO2+H2O=CaSO3↓+ 2HClO |