题目内容
甲、乙、丙、丁四种易溶于水的物质,分别由Na+、Ba2+、Al3+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,已知:①0.1 mol/L甲溶液中c(H+)>0.1 mol/L;②将少量乙溶液分别滴入其他三种物质的溶液时,均有白色沉淀生成;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,下列判断正确的是
| A.甲溶液含有SO42- | B.乙溶液含有SO42- |
| C.丙溶液显酸性 | D.丁溶液显酸性 |
AC
解析试题分析:①根据0.1mol/L甲溶液中c(H+)>0.1mol/L可知,甲溶液一定是硫酸;②能够和硫酸反应生成沉淀,乙中一定有Ba2+,结合③,阴离子只能是OH-、HCO3-;③可以推断丙一定含有Cl-,可能是氯化铝、氯化钠;若是氯化钠,不会和乙生成沉淀,故丙只能是氯化铝,所以甲是硫酸,乙是氢氧化钡,丙是氯化铝,丁是碳酸氢钠。氯化铝水解溶液显酸性,碳酸氢纳溶液中HCO3-的水解程度大于电离程度,所以溶液显碱性,因此正确的答案选AC。
考点:考查离子推断以及检验的有关判断

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列离子方程式书写不正确的是( )
| A.向100mL 1 mol/L溴化亚铁溶液中通入标准状况下的2.24L氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| B.硫酸亚铁溶液与稀硫酸、双氧水混合:Fe2++H2O2+2H+=Fe3++2H2O |
| C.碳酸钙溶于硝酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| D.碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
下列表示对应化学反应的离子方程式正确的是
| A.NO2通入水中:3NO2+H2O=2H++2NO3-+NO |
B.用两个铜电极电解CuSO4溶液:2Cu2++2H2O 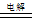 2Cu↓+O2↑+4H+ 2Cu↓+O2↑+4H+ |
| C.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=SO42-+Fe2++4H+ |
| D.过量的CO2通入NaAlO2溶液中:2AlO2-+CO2+3H2O =Al(OH)3↓+CO32- |
下列各组离子在制定的溶液中一定能大量共存的是
| A.无色溶液:K+、Al3+、NO3-、AlO2- |
| B.pH=12的溶液:K+、Cl-、SO32- 、SiO32- |
| C.含0.1mol?L-1 NO3-的溶液:H+、Fe3+、Cl-、SO42- |
| D.由水电离产生的c(H+)=1×10-12 mol?L—1的溶液:Na+、NH4+、SO42-、HCO3- |
某无色溶液中滴入石蕊试液显红色,该溶液中可以大量共存的是
| A.Na+、Cl-、Mg2+、ClO- | B.Fe2+、NH4+、Cl-、NO3一 |
| C.Na+、HCO3-、AlO2一、K+ | D.Na+、Ba2+、Cl-、NO3一 |
含有下列各组离子的溶液中,滴入过量溴水后仍能大量共存的是
| A.Na+、Fe2+、SO42-、Cl― |
| B.Ag+、Al3+、H+、NO3― |
| C.Na+、K+、SO42-、SO32- |
| D.NH4+、Ca2+、NO3―、Cl- |
向含有下列微粒的溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使该微粒浓度下降的是
| A.Fe3+ | B.HS— | C.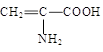 | D.C6H5O— |
下列离子方程式正确的是
| A.醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+ |
| C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
25℃时,下列各组离子在指定溶液中能大量共存的是
| A.滴人甲基橙显红色的溶液中:NH4+、Ba2+、AlO—2、CI— |
B.Kw/c( H+) =0.l mol/L的溶液:Na+、K+、Si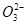 、HC 、HC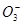 |
C.含有较多S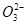 '的溶液:H+、Ca2+、Fe3+、N '的溶液:H+、Ca2+、Fe3+、N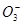 |
D.澄清透明溶液中:K+、M 、H3O+、SO42― 、H3O+、SO42― |