题目内容
20.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: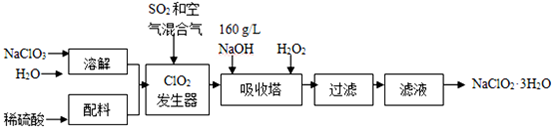
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③160g•L-1 NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1L.
(1)160g•L-1 NaOH溶液的物质的量浓度为4mol/L.若要计算该溶液的质量分数,还需要的一个条件是溶液的密度(用文字说明).
(2)发生器中鼓入空气的作用可能是b(选填序号).
a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防止爆炸 c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.吸收塔的温度不能超过20℃,其目的是防止H2O2分解.
(4)从滤液中得到NaClO2•3H2O粗晶体的实验操作是蒸发浓缩、冷却结晶、过滤
要得到更纯的NaClO2•3H2O晶体必须进行的操作是重结晶(填操作名称)
(5)经查阅资料知道:当pH≤2.0时,ClO2-能被I-完全还原成Cl-;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.
欲测定成品中NaClO2•3H2O的含量,现进行如下操作:
| 步骤I | 称取样品w g配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤II | 向锥形瓶中加入足量KI 晶体,充分搅拌,并加入少量指示剂 |
| 步骤III | 用c mol/L的Na2S2O3溶液滴定 |
步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2•3H2O的质量分数为$\frac{9.05×1{0}^{-2}Vc}{4W}$×100%(用字母表示).
分析 氯酸钠、水和稀硫酸在ClO2发生器中通入二氧化硫和空气反应生成ClO2 ,吸收塔内的反应是氢氧化钠、过氧化氢吸收ClO2 反应生成亚氯酸钠(NaClO2),蒸发浓缩结晶析出,过滤洗涤得到晶体,
(1)浓度g/L表示1L溶液中所含溶质质量的多少,160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH,令溶液体积为1L,计算氢氧化钠的物质的量,利用c=$\frac{n}{V}$计算氢氧化钠溶液的物质的量浓度;若计算该溶液的质量分数,则需要知道溶液的总质量,由m=ρV分析;
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.据此解答.
(3)根据题目信息并运用氧化还原反应理论判断反应物、生成物.根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生.据此书写方程式.
温度过高,H2O2容易分解;
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.得到的粗晶体经过重结晶可得到纯度更高的晶体;
(5)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.溶液颜色蓝色变化为无色分析判断反应终点;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到;
解答 解:(1)浓度g/L表示1L溶液中所含溶质质量的多少,160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH,令溶液体积为1L,则160gNaOH的物质的量为$\frac{160g}{40g/mol}$=4mol,所以该溶液氢氧化钠的物质的量浓度c(NaOH)=$\frac{4mol}{1L}$=4mol/L;若计算该溶液的质量分数,则需要知道溶液的总质量,由m=ρV,可知还需要知道溶液的密度;
故答案为:4mol/L;溶液的密度;
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.发生器中鼓入空气的作用应是稀释ClO2以防止爆炸.
故选:b.
(3)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2.
H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解.
故答案为:2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2;防止H2O2分解.
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,得到的粗晶体经过重结晶可得到纯度更高的晶体.
故答案为:蒸发浓缩、冷却结晶、过滤;重结晶.
(5)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,离子方程式为:ClO2-+4H++4I-=2I2+Cl-+2H2O,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.溶液颜色蓝色变化为无色分析判断反应终点,滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化,
故答案为:ClO2-+4H++4I-=2I2+Cl-+2H2O,滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到,设NaClO2,
ClO2-~2I2~4Na2S2O3+
1 4
x cV×10-3mol
x=$\frac{cV×1{0}^{-3}}{4}$
样品中NaClO2的质量分数=$\frac{\frac{cV×1{0}^{-3}}{4}mol×90.5g/mol}{Wg/mol}$×100%=$\frac{9.05×1{0}^{-2}Vc}{4W}$×100%,
故答案为:$\frac{9.05×1{0}^{-2}Vc}{4W}$×100%;
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力.题目有一定的难度.

 名校课堂系列答案
名校课堂系列答案| 相对分 子质量 | 密度 (g•cm-3) | 沸点 ℃ | 溶解性 | |
| 环己 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
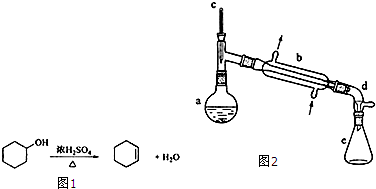
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是D(填正确答案标号).
A.立即补加B.重新配料C.不需补加 D.冷却后补加
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口倒出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有C(填正确答案标号).
A.蒸馏烧瓶B.温度计C.分液漏斗D.冷凝管E.接收器
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0(1)在850℃时,CO和H2O浓度变化如图,则 0~4min的平均反应速率
v(CO2)=0.03mol•L-1•min-1
(2)t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②t1℃时,反应在4min~5min间,平衡向左移动(填“向左”、“向右”或“不移动”),可能的原因是b.
a.增加CO的浓度 b.增加H2的浓度 c.加压 d.使用催化剂.
| A. | 1:1 | B. | 2:1 | C. | 3:4 | D. | 5:4 |
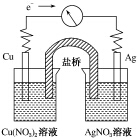 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | Cu作负极,发生还原反应 | |
| C. | 电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液 | |
| D. | 工作一段时间后,AgNO3溶液中c(Ag+)减小 |
 .
.