题目内容
9.同温同压下,甲容器中的NH3和乙容器中的CH4所含的原子总数相同,则甲容器与乙容器的体积之比为( )| A. | 1:1 | B. | 2:1 | C. | 3:4 | D. | 5:4 |
分析 甲容器中的NH3和乙容器中的CH4所含的原子总数相同,则原子物质的量相等,假设原子物质的量均为1mol,结合分子式计算氨气、甲烷物质的量,同温同压下气体体积之比等于物质的量之比,容器的容积等于气体体积.
解答 解:甲容器中的NH3和乙容器中的CH4所含的原子总数相同,则原子物质的量相等,假设原子物质的量均为1mol,则氨气物质的量为$\frac{1mol}{4}$=0.25mol、甲烷物质的量为$\frac{1mol}{5}$=0.2mol,同温同压下气体体积之比等于物质的量之比,则氨气与甲烷体积之比为0.25mol:0.2mol=5:4,容器的容积等于气体体积,则甲容器与乙容器的体积之比为5:4,故选:D.
点评 本题考查阿伏伽德罗定律及其推论,难度不大,关键是根据原子数目相等计算氨气与甲烷物质的量之比.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
20.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: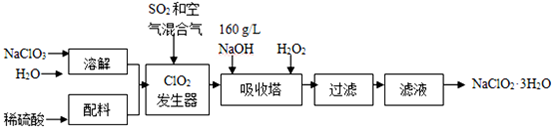
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③160g•L-1 NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1L.
(1)160g•L-1 NaOH溶液的物质的量浓度为4mol/L.若要计算该溶液的质量分数,还需要的一个条件是溶液的密度(用文字说明).
(2)发生器中鼓入空气的作用可能是b(选填序号).
a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防止爆炸 c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.吸收塔的温度不能超过20℃,其目的是防止H2O2分解.
(4)从滤液中得到NaClO2•3H2O粗晶体的实验操作是蒸发浓缩、冷却结晶、过滤
要得到更纯的NaClO2•3H2O晶体必须进行的操作是重结晶(填操作名称)
(5)经查阅资料知道:当pH≤2.0时,ClO2-能被I-完全还原成Cl-;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.
欲测定成品中NaClO2•3H2O的含量,现进行如下操作:
①步骤Ⅱ中发生反应的离子方程式是ClO2-+4H++4I-=2I2+Cl-+2H2O,
步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2•3H2O的质量分数为$\frac{9.05×1{0}^{-2}Vc}{4W}$×100%(用字母表示).

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③160g•L-1 NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1L.
(1)160g•L-1 NaOH溶液的物质的量浓度为4mol/L.若要计算该溶液的质量分数,还需要的一个条件是溶液的密度(用文字说明).
(2)发生器中鼓入空气的作用可能是b(选填序号).
a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防止爆炸 c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.吸收塔的温度不能超过20℃,其目的是防止H2O2分解.
(4)从滤液中得到NaClO2•3H2O粗晶体的实验操作是蒸发浓缩、冷却结晶、过滤
要得到更纯的NaClO2•3H2O晶体必须进行的操作是重结晶(填操作名称)
(5)经查阅资料知道:当pH≤2.0时,ClO2-能被I-完全还原成Cl-;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.
欲测定成品中NaClO2•3H2O的含量,现进行如下操作:
| 步骤I | 称取样品w g配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤II | 向锥形瓶中加入足量KI 晶体,充分搅拌,并加入少量指示剂 |
| 步骤III | 用c mol/L的Na2S2O3溶液滴定 |
步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2•3H2O的质量分数为$\frac{9.05×1{0}^{-2}Vc}{4W}$×100%(用字母表示).
17.在三个密闭容器中分别充入N2、H2、HCl三种气体,当它们的温度和密度都相同时,这三种气体的压强(p),从大到小的顺序是( )
| A. | p(N2)>p(H2)>p(HCl) | B. | p(HCl)>p(N2)>p(H2) | C. | p(H2)>p(HCl)>p(N2) | D. | p(H2)>p(N2)>p(HCl) |
4.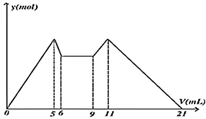 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )| A. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1 | |
| B. | 原混合液中,C(Al3+):C(Mg2+):C(Cl-)=1:1:5 | |
| C. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=1:2 | |
| D. | 从6到9,相应离子反应式H++OH-=H2O |
14.下列物质的分类结果全部正确的是( )
| A. | 纯碱-碱 硫化氢-酸 小苏打-酸式盐 | |
| B. | 碘酒-混合物 胆矾-纯净物 臭氧-单质 | |
| C. | 葡萄糖-电解质 CO2-酸性氧化物 蛋白质溶液-胶体 | |
| D. | 氨水-电解质 硫酸钡-非电解质 酒精-有机物 |
19.下列有关氯气的说法中,错误的是( )
| A. | 氯气是有毒的气体 | |
| B. | 氯气可以与水反应生成有漂白作用的HClO | |
| C. | 氯气可以与氢氧化钠反应用于尾气的处理 | |
| D. | 实验室用加热分解KClO3的方法制取Cl2 |