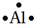题目内容
6.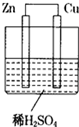 如图所示的原电池装置,则:
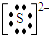
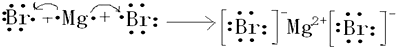
如图所示的原电池装置,则:①负极为:Zn,电极反应式是:Zn-2e-═Zn2+正极为:Cu,电极反应式是:2H++2e-═H2
②电解质溶液中SO42-向Zn极移动,电子的流向是:Zn→Cu
③若有0.5mol电子流经导线,则可产生0.25mol气体,电池工作一段时间后,电解质溶液的pH(填“增大”、“减小”或“不变”)增大.
分析 根据锌比铜活泼,所以锌作负极,氢离子在正极Cu上得电子生成氢气,电解质溶液中阴离子影响负极,电子从负极经导线流向正极,据正极电极反应式计算生成氢气的物质的量,消耗氢离子pH增大,据此分析.
解答 解:①锌比铜活泼,所以锌作负极,Zn失电子生成离子,电极反应式为Zn-2e-═Zn2+,氢离子在正极Cu上得电子生成氢气,电极反应式为2H++2e-═H2,故答案为:Zn;Zn-2e-═Zn2+;Cu;2H++2e-═H2;
②电解质溶液中阴离子影响负极,电子从负极经导线流向正极,故答案为:Zn;Zn→Cu;
③据电极反应式2H++2e-═H2可知有0.5mol电子流经导线,则可产生0.25mol氢气,正极消耗氢离子溶液pH增大,故答案为:0.25;增大.
点评 本题以原电池为载体考查了有关计算,明确各物理量之间的关系是解本题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,常温下其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 乙的常见氧化物有两种 | |
| B. | 气态氢化物稳定性:丙>丁 | |
| C. | 丙的氧化物能与戊的氢化物的水溶液反应 | |
| D. | 原子半径大小:甲>丙 |
16.如图是元素周期表中短周期的一部分,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z两种元素的原子序数之和.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | X元素Z能形成气态氢化物XH3 | B. | Z与W形成的化合物在熔融时能导电 | ||
| C. | 自然界存在大量的单质Z | D. | X与Y形成的化合物不超过3种 |
14.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
| A. | 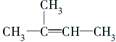 +Br2(CCl4)→ +Br2(CCl4)→ | |
| B. | CH2=CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | |
| C. | CH3-CH=CH2+H2O$→_{加热、加压}^{催化剂}$ | |
| D. | CH4+Cl2$\stackrel{光照}{→}$ |
1.丙烯酸的结构简式为CH2=CH-COOH,其对应的性质中不正确的是( )
| A. | 与钠反应放出氢气 | B. | 能与溴水发生加成反应 | ||
| C. | 能与溴水发生取代反应 | D. | 能发生加聚反应生成高分子化合物 |
18.氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
| A. | 分散质粒子大小都在1~100nm之间 | B. | 有丁达尔效应 | ||
| C. | 加热蒸干、灼烧后都有氧化铁生成 | D. | 呈红褐色 |
15.下列有机物:①CH3OH ②CH3CH2OH ③CH3CHOHCH2CH3 ④(CH3)2CHCH2OH⑤HOCH2CH(CH3)2⑥(CH3)3COH下列判断正确的是( )
| A. | ①②③④⑤⑥之间的关系为同系物 | B. | ③⑥不是同分异构体 | ||
| C. | 可发生消去反应的有机物有4 | D. | 能被催化氧化为醛的有机物有4种 |
 ;
;