题目内容
14.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )| A. | 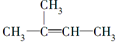 +Br2(CCl4)→ +Br2(CCl4)→ | |
| B. | CH2=CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | |
| C. | CH3-CH=CH2+H2O$→_{加热、加压}^{催化剂}$ | |
| D. | CH4+Cl2$\stackrel{光照}{→}$ |
分析 物质发生化学反应生成产物一定是纯净物,要求反应在一定条件下不能有副反应存在,根据各物质化学性质的反应规律进行判断.
解答 解:A、CH3-CH=C(CH3)2是不对称烯烃,但和溴单质反应加成产物只得到一种,故A正确;
B、CH2=CH-CH2CH3是不对称烯烃,与HCl加成,可得到两种加成产物,故B错误;
C、CH3-CH=CH2是不对称烯烃,与水加成得到两种不同加成产物,故C错误;
D、CH4+Cl2发生取代反应,同时生成一氯取代、二氯取代、三氯取代、四氯取代产物的混合物,故D错误;故选A.
点评 本题考查了加成反应和取代反应的反应特征,主要考查不对称烯烃加成产物的判断,难度不大.

练习册系列答案
相关题目
4.X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体.W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等.下列说法正确的是( )
| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:X<Z | |
| C. | 最高价氧化物对应水化物的碱性:Y<W | |
| D. | Y、Z的氧化物都有酸性和碱性 |
2.已知下表数据:
某学生做乙酸乙酯的制备实验
(1)写出该反应的化学反应式CH3COOH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)按装置图安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是漏加浓硫酸.
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是乙醇的沸点低,易挥发而损耗.
按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物.现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.在图中圆括号表示加入适当的试剂,编号表示适当的分离方法.
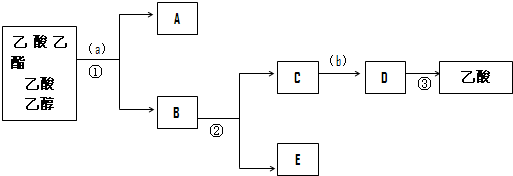
写出加入的试剂:试剂(a)是饱和碳酸钠;试剂(b)是稀硫酸溶液
写出有关的操作分离方法:①是分液,②是蒸馏,③是蒸馏.
(6)在得到的A中加入无水碳酸钠粉末,振荡,目的是除去乙酸乙酯中混有的少量水.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |
(1)写出该反应的化学反应式CH3COOH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)按装置图安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是漏加浓硫酸.
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是乙醇的沸点低,易挥发而损耗.
按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物.现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.在图中圆括号表示加入适当的试剂,编号表示适当的分离方法.

写出加入的试剂:试剂(a)是饱和碳酸钠;试剂(b)是稀硫酸溶液
写出有关的操作分离方法:①是分液,②是蒸馏,③是蒸馏.
(6)在得到的A中加入无水碳酸钠粉末,振荡,目的是除去乙酸乙酯中混有的少量水.
19.下列各组混合物不能用分液漏斗分离的是( )
| A. | 硝基苯和水 | B. | 乙酸乙酯和水 | C. | 乙醇和水 | D. | 溴苯和NaOH溶液 |
3.物质的量相同的下列各组有机物,充分燃烧耗氧量相同的一组是( )
| A. | C2H4 C2H6 | B. | C2H4 C3H6 | C. | C2H4 C2H6O | D. | C2H6O C2H4O2 |
 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:

 -CH2CH3+18KMnO4+27H2SO4→5HOOC-
-CH2CH3+18KMnO4+27H2SO4→5HOOC- -COOH+9K2SO4+18MnSO4+5CO2↑+42H2O
-COOH+9K2SO4+18MnSO4+5CO2↑+42H2O 如图所示的原电池装置,则:
如图所示的原电池装置,则: