题目内容
11.有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3.试回答下列问题:(1)A元素的名称是氢,E元素在周期表中的位置是第三周期ⅠA族;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是H2O>NH3>H2S(填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是
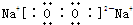 ;
;(4)化合物X、Y均由A、D、E、F四种元素组成.
①X、Y均属于离子晶体;
②X与Y的水溶液相混合发生反应的离子方程式为H++HSO3-=H2O+SO2↑;
(5)向化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成.其离子反应方程式为:S2-+H2O2+2H+$\frac{\underline{\;\;△\;\;}}{\;}$S↓+2H2O;
(6)若由A、C组成的简单氢化物燃烧生成无污染物,燃烧热为aKJ/mol,请写出表示该简单氢化物燃烧热的热化学方程式NH3(g)+$\frac{3}{4}$O2(g)═$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l);△H=-aKJ/mol.
分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A原子核内无中子,则A为H元素;A和E同主族,结合原子序数可知E为Na;B与D最外层电子数之比为2:3,由原子序数可知,二者都处于第二周期且不相邻,故B、D原子最外层电子数分别为4、6,可推知B为C元素、D为O元素,则C为N元素;D和F同主族,则F为S元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A原子核内无中子,则A为H元素;A和E同主族,结合原子序数可知E为Na;B与D最外层电子数之比为2:3,由原子序数可知,二者都处于第二周期且不相邻,故B、D原子最外层电子数分别为4、6,可推知B为C元素、D为O元素,则C为N元素;D和F同主族,则F为S元素.
(1)由上述分析可知,A为氢元素;E为Na元素,处于周期表中第三周期ⅠA族,
故答案为:氢;第三周期ⅠA族;
(2)非金属性O>N>S,故N、O、S元素氢化物的稳定性H2O>NH3>H2S,
故答案为:H2O>NH3>H2S;
(3)Na单质在足量氧气中燃烧生成的化合物为Na2O2,其电子式为: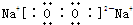 ,
,
故答案为: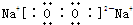 ;
;
(4)化合物X、Y均由H、O、Na、S四种元素组成,分别为NaHSO3、NaHSO4中的一种,
①NaHSO3、NaHSO4均属于离子化合物;
②X与Y的水溶液相混合发生反应的离子方程式为:H++HSO3-=H2O+SO2↑;
故答案为:离子;H++HSO3-=H2O+SO2↑;
(5)化合物Na2S的水溶液中滴入双氧水和稀硫酸,加热,生成单质为S,同时生成水,其反应离子方程式为:S2-+H2O2+2H+$\frac{\underline{\;\;△\;\;}}{\;}$S↓+2H2O,
故答案为:S2-+H2O2+2H+$\frac{\underline{\;\;△\;\;}}{\;}$S↓+2H2O;
(6)若由A、C组成的简单氢化物为氨气,氨气燃烧生成无污染物,该产物应该为氮气,氨气的燃烧热为aKJ/mol,则氨气燃烧热的热化学方程式为:NH3(g)+$\frac{3}{4}$O2(g)═$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l);△H=-aKJ/mol,
故答案为:NH3(g)+$\frac{3}{4}$O2(g)═$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l);△H=-aKJ/mol.
点评 本题考查结构性质位置关系综合应用,难度不大,推断元素是解题关键,注意充分利用原子序数关系确定元素,(6)为易错点,学生容易忽略书写燃烧热的热化学方程式.

| A. | CaO | B. | CO2 | C. | NaOH | D. | CaCl2 |
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |
(1)写出该反应的化学反应式CH3COOH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)按装置图安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是漏加浓硫酸.
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是乙醇的沸点低,易挥发而损耗.
按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物.现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.在图中圆括号表示加入适当的试剂,编号表示适当的分离方法.
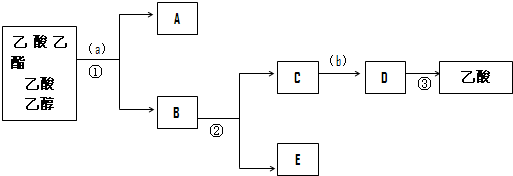
写出加入的试剂:试剂(a)是饱和碳酸钠;试剂(b)是稀硫酸溶液
写出有关的操作分离方法:①是分液,②是蒸馏,③是蒸馏.
(6)在得到的A中加入无水碳酸钠粉末,振荡,目的是除去乙酸乙酯中混有的少量水.
| A. | 硝基苯和水 | B. | 乙酸乙酯和水 | C. | 乙醇和水 | D. | 溴苯和NaOH溶液 |
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 还原性:Cl->Br->I- |
| A. | C2H4 C2H6 | B. | C2H4 C3H6 | C. | C2H4 C2H6O | D. | C2H6O C2H4O2 |
| A. | 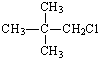 | B. | 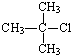 | C. | 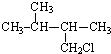 | D. | 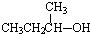 |
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 放热反应一定比吸热反应的反应速率快 | |
| C. | 由焓判据和熵判据组合而成的复合判据,将更适合于所有的反应过程 | |
| D. | 反应速率快的反应,其反应物的转化率一定高 |
 如图所示的原电池装置,则:
如图所示的原电池装置,则: