题目内容
16.(1)用电子式表示.①铝原子
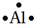
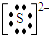
②硫离子
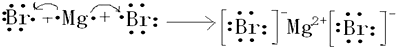
③溴化镁的形成过程
(2)在${\;}_{3}^{6}$Li、${\;}_{7}^{14}$N、${\;}_{11}^{23}$Na、${\;}_{12}^{24}$Mg、${\;}_{3}^{7}$Li、${\;}_{6}^{14}$C中:
①63Li和73Li互为同位素.
②146C和147N质量数相等,但不能互称同位素.
③2311Na和2412Mg的中子数相等,但质子数不相等,所以不是同一种元素.
分析 (1)①依据元素的原子最外层电子个数的多少,先用小黑点“•”(或“×”)等符号在元素符号上、下、左、右各表示出1个电子,多余的电子配对;
②阴离子:无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷;
③溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示其形成过程时,左边是原子的电子式,右边为溴化镁的电子式,中间用箭头连接;
(2)具有相同质子数、不同中子数的原子互为同位素;在原子的构成中,元素符号左上角的数字表示原子的质量数;原子中,质量数=质子数+中子数,据此解答即可.
解答 解:(1)①铝原子最外层为3个电子,氯原子的电子式为 ,故答案为:
,故答案为: ;
;
②硫离子为阴离子,电子式中需要标出所带电荷及最外层电子,硫离子的电子式为: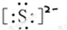 ,故答案为:
,故答案为: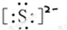 ;
;
③溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示的形成过程为 ,故答案为:
,故答案为: ;
;
(2)①63Li和73Li的质子数都是3,中子数分别为6-3=3、7-3=4,即质子数相同、中子数不同的同种元素的原子,则互为同位素,故答案为:63Li、73Li;
②146C和 147N的质量数都是14,质子数分别为6、7,中子数分别为8、7,质子数等于电子数,即质量数相同,但不是同位素,故答案为:146C、147N;
③2311Na和2412Mg的质子数分别为11、12,质量数分别为23、24,中子数分别为23-11=12、24-12=12,即中子数相同,但不是同一种元素,故答案为:2311Na、2412Mg.
点评 本题考查了电子式的书写、同位素的判断、质量数与质子数和中子数的关系等,题目难度不大,注意掌握电子式的概念及正确的书写方法,明确原子、阴阳离子的电子式的区别.

练习册系列答案
相关题目
7.化学工艺中倡导无污染的绿色化学是一场新的技术革命.若使用单质铜制硝酸铜,下列方案中,耗用原料最经济,而且对环境几乎没有污染的是( )
| A. | Cu和稀硝酸反应制Cu(NO3)2 | |
| B. | Cu和浓硝酸反应制Cu(NO3)2 | |
| C. | 铜在空气中受热转化为CuO,再溶于稀硝酸制Cu(NO3)2 | |
| D. | 铜在氧气中受热转化为CuO,再溶于浓硝酸制Cu(NO3)2 |
4.有5种单核粒子,它们分别是 ${\;}_{19}^{40}$□、${\;}_{18}^{40}$□+、${\;}_{19}^{40}$□+、${\;}_{20}^{40}$□2+、${\;}_{20}^{41}$□(“□”内元素符号未写出),则它们所属元素的种类有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
1.下列说法正确的是( )
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 放热反应一定比吸热反应的反应速率快 | |
| C. | 由焓判据和熵判据组合而成的复合判据,将更适合于所有的反应过程 | |
| D. | 反应速率快的反应,其反应物的转化率一定高 |
5.某化合物的性质如下:①加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体;②溶于水,加入硝酸钡溶液,产生能溶于稀硝酸的白色沉淀.则该物质是( )
| A. | NH4Cl | B. | (NH4)2CO3 | C. | NaCl | D. | K2SO4 |
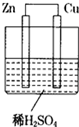 如图所示的原电池装置,则:
如图所示的原电池装置,则: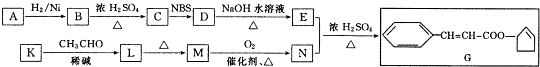

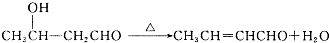
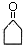 ,G中官能团的名称为酯基、碳碳双键.
,G中官能团的名称为酯基、碳碳双键. +CH3CHO$\stackrel{碱}{→}$
+CH3CHO$\stackrel{碱}{→}$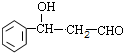 ,反应类型加成反应.
,反应类型加成反应.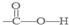 .
.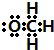 ]-.
]-.