题目内容
10.乌头酸的结构简式如图所示,下列关于乌头酸的说法不正确的是( )
| A. | 化学式为C6H6O6 | |
| B. | 乌头酸能使酸性高锰酸钾溶液或溴水褪色 | |
| C. | 乌头酸能发生水解反应和加成反应 | |
| D. | 含l mol乌头酸的溶液最多可消耗3 mol NaOH |
分析 该物质中含有酯基、羧基、碳碳双键,具有羧酸和烯烃性质,能发生氧化反应、酯化反应、中和反应、加成反应、加聚反应、取代反应等,据此分析解答.
解答 解:A.分子式为C6H6O6,故A正确;
B.含有碳碳双键,所以能和溴发生加成反应、能被酸性高锰酸钾溶液氧化而使二者褪色,故B正确;
C.该分子中不含酯基,所以不能发生水解反应,故C错误;
D.该分子中羧基能和NaOH反应,含l mol乌头酸的溶液最多可消耗3 mol NaOH,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查羧酸和烯烃性质,易错点是分子式判断.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
20.以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )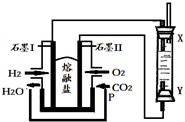

| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | X端为电解池的阳极 |
1.X、Y、Z、W是元素周期表中前四周期中的常见元素,其相关信息如下表:
(1)Z位于元素周期表第二周期第VA族,W的基态原子核外有4个未成对电子.
(2)Z的气态氢化物比Y的气态氢化物熔点NH3 (填“高”或“低”),原因是NH3分子间形成氢键
(3)X与Y可形成多种化合物,其中以直线型存在的4核分子中σ键与π键之比为3:2,
(4)Z与X组成的一种气态化合物还原性较强,试写出还原CuO且产物对环境无污染的化学方程式:2NH3+3CuO═3Cu+N2+3H2O
(5)可用YX4还原ZOx以消除污染.
YX4(g)+4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574.0KJ?mol
YX4(g)+4ZO(g)=2Z2(g)+YO2(g)+2X2O(g) H=-1160.0KJ/mol
试写出YX4还原ZO2至Z2的热化学方程式:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0KJ?mol.
| 元素 | 相关信息 |
| X | X的单质是密度最小的气体. |
| Y | Y的一种核素常用于考古且其一种同素异形体是较软的物质之一. |
| Z | Z是其气态氢化物的水溶液显碱性的元素. |
| W | W是地壳中含量居于第二位的金属. |
(2)Z的气态氢化物比Y的气态氢化物熔点NH3 (填“高”或“低”),原因是NH3分子间形成氢键
(3)X与Y可形成多种化合物,其中以直线型存在的4核分子中σ键与π键之比为3:2,
(4)Z与X组成的一种气态化合物还原性较强,试写出还原CuO且产物对环境无污染的化学方程式:2NH3+3CuO═3Cu+N2+3H2O
(5)可用YX4还原ZOx以消除污染.
YX4(g)+4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574.0KJ?mol
YX4(g)+4ZO(g)=2Z2(g)+YO2(g)+2X2O(g) H=-1160.0KJ/mol
试写出YX4还原ZO2至Z2的热化学方程式:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0KJ?mol.
18.在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等多种“分子”改变过人类的世界.
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-空间构型为平面三角形,写出与NO3-为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b)kJ
(5)OF2与H2O分子结构十分相似,但H2O分子的极性很强,而OF2分子的极性却很小.试从原子的电负性和中心原子上的孤电子对角度解释原因:从电负性上看,氧与氢的电负性大于氧与氟的电负性差值;②OF2中氧原子上有两对孤电子对,抵消了F-O键中共用电子对偏向F而产生的极性
(6)铜元素与氢元素形成的一种红色离子化合物,其晶体结构如图2所示.则该晶体的化学式为CuH,密度为$\frac{6×65}{\frac{3\sqrt{3}}{2}a{b}^{2}×1{0}^{-30}{N}_{A}}$g.cm-3(列式即可,阿佛加特罗定律常数的值用NA表示)
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-空间构型为平面三角形,写出与NO3-为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b)kJ
| 化学键 | Si-Si | O═O | Si-O | |
| 键能(kJ•mol-1) | a | b | c | |
(6)铜元素与氢元素形成的一种红色离子化合物,其晶体结构如图2所示.则该晶体的化学式为CuH,密度为$\frac{6×65}{\frac{3\sqrt{3}}{2}a{b}^{2}×1{0}^{-30}{N}_{A}}$g.cm-3(列式即可,阿佛加特罗定律常数的值用NA表示)
5.分子式为C8H10O的某芳香化合物有多种结构,其中含有-CH2OH基团的有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
15.下列图象表达正确的是( )
| A. | 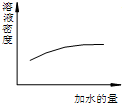 浓硫酸的稀释 浓硫酸的稀释 | |
| B. | 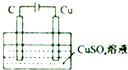 某电极上有铜产生,且溶液中铜离子浓度不变 | |
| C. |  微粒电子数 微粒电子数 | |
| D. | 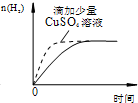 过量的盐酸和等量的锌粉反应 过量的盐酸和等量的锌粉反应 |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、SiO32-、NO3- | |
| B. | 0.1 mol•L-1 Na2CO3溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 0.1 mol•L-1NaClO溶液:Na+、NH4+、SO32-、CO32- | |
| D. | 0.1 mol•L-1Na[Al(OH)4]溶液:K+、Na+、SO42-、HCO3- |
14.2009年5月31日 是世界卫生组织发起的第22届世界无烟日.据报道,目前全球有13亿吸烟者,中国就有3.5亿人吸烟,每年有120万人因吸烟而死亡,占全球与吸烟有关疾病死亡人数的$\frac{1}{4}$.为了你和他人的健康,要远离烟草,养成良好健康的生活习惯.下列有关说法正确的是( )
| A. | 香烟烟气中只有尼古丁有毒 | |
| B. | 市售香烟通常装有过滤嘴,所以吸烟对人体无害 | |
| C. | 吸烟只影响自己的健康,不影响他人的健康 | |
| D. | 香烟烟气中的一氧化碳比氧气更容易与血红蛋白结合 |