题目内容
8.已知二甲苯有3种同分异构体,二甲苯中苯环上的一溴代物共有6种,其熔点见下表:| 6种一溴二甲苯的熔点/℃ | 234 | 206 | 213.8 | 204 | 214.5 | 205 |
| 对应二甲苯的熔点/℃ | 13 | -54 | -27 | -54 | -27 | -54 |
| A. |  | B. |  | C. |  | D. |  |
分析 二甲苯有三种同分异构体,分别为对二甲苯、间二甲苯和邻二甲苯.其一溴代物分别有1种、3种和2种.根据表中对应二甲苯的熔点可判断,熔点为13℃的二甲苯只有一种一溴代物,熔点为-54℃的二甲苯有3种一溴代物,而熔点为-27℃的二甲苯有2种一溴代物.因此熔点为13℃的二甲苯是对二甲苯,熔点为-54℃的二甲苯是间二甲苯,熔点为-27℃的二甲苯是邻二甲苯.
解答 二甲苯有三种同分异构体,分别为对二甲苯、间二甲苯和邻二甲苯.其一溴代物分别有1种、3种和2种.根据表中对应二甲苯的熔点可判断,熔点为13℃的二甲苯只有一种一溴代物,熔点为-54℃的二甲苯有3种一溴代物,而熔点为-27℃的二甲苯有2种一溴代物.因此熔点为13℃的二甲苯是对二甲苯,熔点为-54℃的二甲苯是间二甲苯,熔点为-27℃的二甲苯是邻二甲苯.熔点为234℃的一溴二甲苯所对应的二甲苯是13℃的二甲苯,
由上述分析可知,熔点为234℃的一溴代二甲苯对应的是熔点为-13℃二甲苯:对二甲苯,对二甲苯苯环上的一溴代物的结构简式为: ;故选B.
;故选B.
点评 本题考查同分异构现象和同分异构体等,题目难度较大,注意掌握等效氢原子的判断方法,根据表中数据判断同分异构体的一溴代物沸点相近是关键.

练习册系列答案
相关题目
14.分子式为C5H10O2,能与NaOH反应且有3个甲基的同分异构体共有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
16.下列说法不正确的是( )
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 某物质的结构为 ,与其互为同分异构且完全水解后产物相同的油脂有两种 ,与其互为同分异构且完全水解后产物相同的油脂有两种 | |
| C. | 用溴水即可鉴别四氯化碳、2-己烯和甲苯 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
3.下列指定溶液中,一定能大量共存的离子组是( )
| A. | 常温下,由水电离出的氢离子浓度c(H+)=1×10-13mol/L的溶液中:Fe2+、NO3-、Ba2+、Cl- | |
| B. | 含有大量Al3+的溶液中:Na+、K+、NO3-、SiO32- | |
| C. | 无色透明溶液中:Mg2+、Fe3+、SO42-、SCN- | |
| D. | pH=13的溶液中:AlO2-、Na+、Cl-、CO32- |
13. 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )
 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )| A. | 原AgNO3溶液的物质的量浓度为0.1 mol•L-1 | |
| B. | 图中X点的坐标为(10,6) | |
| C. | 图中X点对应溶液中Ag+与Cl-的浓度不相同 | |
| D. | 若把0.1 mol•L-1的NaCl溶液换成0.1 mol•L-1的NaI溶液,则图象在终点后变为虚线部分 |
20.以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )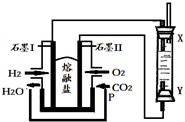

| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | X端为电解池的阳极 |
17. 柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
 柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )| A. | BAP导电性优良,因其有共轭双键结构 | |
| B. | 五环多环芳香烃类都是BAP的同分异构体 | |
| C. | BAP有10种一硝基取代物 | |
| D. | BAP的分子式为C20H12 |
18.在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等多种“分子”改变过人类的世界.
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-空间构型为平面三角形,写出与NO3-为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b)kJ
(5)OF2与H2O分子结构十分相似,但H2O分子的极性很强,而OF2分子的极性却很小.试从原子的电负性和中心原子上的孤电子对角度解释原因:从电负性上看,氧与氢的电负性大于氧与氟的电负性差值;②OF2中氧原子上有两对孤电子对,抵消了F-O键中共用电子对偏向F而产生的极性
(6)铜元素与氢元素形成的一种红色离子化合物,其晶体结构如图2所示.则该晶体的化学式为CuH,密度为$\frac{6×65}{\frac{3\sqrt{3}}{2}a{b}^{2}×1{0}^{-30}{N}_{A}}$g.cm-3(列式即可,阿佛加特罗定律常数的值用NA表示)
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-空间构型为平面三角形,写出与NO3-为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b)kJ
| 化学键 | Si-Si | O═O | Si-O | |
| 键能(kJ•mol-1) | a | b | c | |
(6)铜元素与氢元素形成的一种红色离子化合物,其晶体结构如图2所示.则该晶体的化学式为CuH,密度为$\frac{6×65}{\frac{3\sqrt{3}}{2}a{b}^{2}×1{0}^{-30}{N}_{A}}$g.cm-3(列式即可,阿佛加特罗定律常数的值用NA表示)