题目内容
下列叙述:
①非金属元素的单质M能从Q的化合物中置换出非金属单质Q;
②M原子比Q原子容易得到电子;
③单质M跟H2反应比Q跟H2容易的多;
④氢化物水溶液的酸性HmM>HnQ;
⑤氧化物对应水化物的酸性HmMOx>HnQOy;
⑥熔点:M>Q;
⑦金属键M>Q.
能说明非金属元素M比非金属元素Q强的是( )
①非金属元素的单质M能从Q的化合物中置换出非金属单质Q;
②M原子比Q原子容易得到电子;
③单质M跟H2反应比Q跟H2容易的多;
④氢化物水溶液的酸性HmM>HnQ;
⑤氧化物对应水化物的酸性HmMOx>HnQOy;
⑥熔点:M>Q;
⑦金属键M>Q.
能说明非金属元素M比非金属元素Q强的是( )
| A、①②③ | B、①②③⑦ |
| C、①②③⑤⑦ | D、①②③④⑤⑦ |
考点:非金属在元素周期表中的位置及其性质递变的规律,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:比较元素的非金属性强弱,可从与氢气反应的剧烈程度、氢化物的稳定性、最高价氧化物对应水化物的酸性强弱等角度判断,注意不能根据得失电子的多少以及熔沸点的高低等角度判断.
解答:
解:①非金属单质M能从Q的化合物中置换出非金属单质Q,可说明M比N的非金属性强,故①正确;
②M原子比Q原子容易得到电子,可说明M比Q的非金属性强,故②正确;
③单质M跟H2反应比Q跟H2反应容易得多,则M易得电子,所以M比Q的非金属性强,故③正确;
④不能利用氢化物的水溶液的酸性比较非金属性的强弱,故④错误;
⑤氧化物水化物的酸性HmMOx>HnQOy,不一定为最高价氧化物对应的水化物的酸性,则不能说明M、Q的非金属性强弱,故⑤错误;
⑥M的单质熔点比Q的高,属于物理性质,与得失电子的能力无关,不能用来判断非金属性的强弱,故⑥错误;
⑦金属键M>Q,与得失电子的能力无关,不能用来判断非金属性的强弱,故⑦错误.
正确的有①②③,
故选A.
②M原子比Q原子容易得到电子,可说明M比Q的非金属性强,故②正确;
③单质M跟H2反应比Q跟H2反应容易得多,则M易得电子,所以M比Q的非金属性强,故③正确;
④不能利用氢化物的水溶液的酸性比较非金属性的强弱,故④错误;
⑤氧化物水化物的酸性HmMOx>HnQOy,不一定为最高价氧化物对应的水化物的酸性,则不能说明M、Q的非金属性强弱,故⑤错误;
⑥M的单质熔点比Q的高,属于物理性质,与得失电子的能力无关,不能用来判断非金属性的强弱,故⑥错误;
⑦金属键M>Q,与得失电子的能力无关,不能用来判断非金属性的强弱,故⑦错误.
正确的有①②③,
故选A.
点评:本题考查非金属性的比较,为高频考点,本题注意把握比较非金属性的角度,注意元素周期律的变化,题目难度不大.

练习册系列答案
相关题目
在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g)?XC(g)+D(S),向家中通入6molA和2molB,向乙中通入1.5molA、0.5molB、3molC和2molD,反应一段时间后都达到平衡,此时测的甲、乙两个容器中的C的体积分数都是0.2,下列叙述中正确的是( )
| A、平衡时甲中的A的体积分数为0.4 |
| B、平衡时甲、乙两个容器中的A、B的物质的量之比不相等 |
| C、若平衡时两容器中的压强不相等,则两容器中的压强之比为8:5 |
| D、若平衡时甲、乙两容器中的A的物质的量相等,则x=4 |
常温下,下列说法正确的是( )
| A、将pH=2的酸溶液稀释10倍,溶液的pH一定变为3 |
| B、将pH=2的盐酸溶液和pH=4的盐酸溶液等体积混合后,溶液的pH变为3 |
| C、将pH=12的Ba(OH)2溶液稀释10倍,溶液的pH变为13 |
| D、将pH=a的盐酸与pH=b的NaOH溶液等体积混合后,若pH=7,则a+b=14 |
根据转化关系判断下列说法不正确的是( )


| A、反应①中,(C6H10O5)n可表示淀粉或纤维素 |
| B、反应②中,1mol葡萄糖可生成2mol乙醇 |
| C、乙醇、乙酸和乙酸乙酯互为同系物 |
| D、将铜丝在空气中灼烧后趁热插入乙醇中可得到乙醛 |
室温时,将V1 mL c1 mol/L的NaOH溶液滴加到 V2 mL c2 mol/L的醋酸中,下述结论中正确的是( )
| A、若混合溶液的pH=7,则c1V1>c2V2 |
| B、若V1=V2、c1=c2,则混合溶液中c(Na+)=c(Ac-) |
| C、若混合溶液的pH=7,则混合溶液中c(Na+)=c(Ac-) |
| D、若V1=V2,且混合溶液的pH>7,则一定有c1>c2 |
下列反应中反应物的总能量小于生成物的总能量的是( )
| A、电解水制取H2和O2 |
| B、甲烷燃烧 |
| C、铝粉与氧化铁粉末反应 |
| D、油脂在人体内完全氧化生成CO2和H2O |
关于下列装置说法不正确的是( )
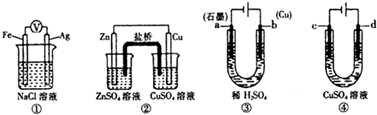

| A、装置①中滴入2滴黄色K3[Fe(CN)6]溶液,溶液中可能出现蓝色沉淀 | ||||
| B、装置②盐桥中的阳离子移向ZnSO4溶液 | ||||
C、装置③中反应的离子方程式为:Cu+2H+
| ||||
| D、用装置④精炼铜时,d电极为粗铜 |
下列措施中,能减慢化学反应速率的是( )
| A、食物储存在冰箱里 |
| B、将块状固体药品研细后再反应 |
| C、用MnO2作H2O2分解反应的催化剂 |
| D、用30%H2SO4溶液代替5%H2SO4溶液与锌粒反应 |