题目内容
关于下列装置说法不正确的是( )
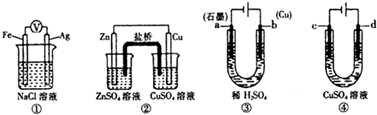

| A、装置①中滴入2滴黄色K3[Fe(CN)6]溶液,溶液中可能出现蓝色沉淀 | ||||
| B、装置②盐桥中的阳离子移向ZnSO4溶液 | ||||
C、装置③中反应的离子方程式为:Cu+2H+
| ||||
| D、用装置④精炼铜时,d电极为粗铜 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.形成原电池反应,为铁的吸氧腐蚀装置;
B.锌为负极,铜为正极,阳离子向正极移动;
C.为电解装置,阳极铜被氧化,阴极生成氢气;
D.精炼铜时,粗铜为阳极.
B.锌为负极,铜为正极,阳离子向正极移动;
C.为电解装置,阳极铜被氧化,阴极生成氢气;
D.精炼铜时,粗铜为阳极.
解答:
解:A.形成原电池反应,铁为负极,被氧化生成亚铁离子,滴入2滴黄色K3[Fe(CN)6]溶液,溶液中出现蓝色沉淀,故A正确;
B.锌为负极,铜为正极,阳离子向正极移动,即移向硫酸铜溶液,故B错误;
C.为电解装置,阳极铜被氧化,阴极生成氢气,总反应式为Cu+2H+
Cu2++H2↑,故C正确;
D.精炼铜时,粗铜为阳极,纯铜为阴极,可在阴极得到纯净的铜,故D正确.
故选B.
B.锌为负极,铜为正极,阳离子向正极移动,即移向硫酸铜溶液,故B错误;
C.为电解装置,阳极铜被氧化,阴极生成氢气,总反应式为Cu+2H+
| ||
D.精炼铜时,粗铜为阳极,纯铜为阴极,可在阴极得到纯净的铜,故D正确.
故选B.
点评:本题考查较为综合,涉及原电池和电解池知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握原电池和电解池的工作原理,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知G是一种具有和卤素单质相似的化学性质的直线型分子,J是一种角型分子.G和J按物质的量之比1:1反应后生成直线型分子L和分子M(组成G、J、L、M的元素的原子序数均小于10).分析如图,指出下列判断错误的是( )


| A、常温下J为液态,能与某种活泼非金属单质反应,产生具有氧化性的单质气体 |
| B、组成G的两种元素中,一种元素能与J中的两种元素分别形成直线型分子 |
| C、L的水溶液呈酸性,与等物质的量的氢氧化钠溶液反应后的溶液呈中性 |
| D、M可能是一种不稳定的弱酸性物质 |
下列叙述中正确的是( )
| A、摩尔物质约含有6.02×1023个构成这种物质的微粒 |
| B、氧气的摩尔质量是32g |
| C、1mol任何气体的气体摩尔体积都约是22.4L?mol-1 |
| D、1mol?L-1硫酸溶液的含义是指1L水中含有lmol硫酸 |
下列叙述:
①非金属元素的单质M能从Q的化合物中置换出非金属单质Q;
②M原子比Q原子容易得到电子;
③单质M跟H2反应比Q跟H2容易的多;
④氢化物水溶液的酸性HmM>HnQ;
⑤氧化物对应水化物的酸性HmMOx>HnQOy;
⑥熔点:M>Q;
⑦金属键M>Q.
能说明非金属元素M比非金属元素Q强的是( )
①非金属元素的单质M能从Q的化合物中置换出非金属单质Q;
②M原子比Q原子容易得到电子;
③单质M跟H2反应比Q跟H2容易的多;
④氢化物水溶液的酸性HmM>HnQ;
⑤氧化物对应水化物的酸性HmMOx>HnQOy;
⑥熔点:M>Q;
⑦金属键M>Q.
能说明非金属元素M比非金属元素Q强的是( )
| A、①②③ | B、①②③⑦ |
| C、①②③⑤⑦ | D、①②③④⑤⑦ |
在某温度下,可逆反应mA(g)+nB(g)?pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )
| A、平衡常数发生变化,化学平衡必发生移动 |
| B、化学平衡发生移动,平衡常数必发生变化 |
| C、反应物的转化率越大,达到平衡时,K值越大 |
| D、温度越高,达到平衡时,K值越大 |
PbO2在酸性溶液中能将Mn2+氧化成MnO4-,本身被还原为Pb2+.取一支试管,加入适量PbO2固体和适量的稀H2SO4后滴入2mL 1mol/L MnSO4溶液.下列说法错误的是( )
| A、充分振荡后静置,溶液颜色变为紫色 |
| B、上述实验中不能用盐酸代替硫酸 |
| C、在酸性条件下,PbO2的氧化性比MnO4-的氧化性强 |
| D、若上述实验完全反应,消耗PbO2的物质的量为0.01mol |
化学与生活密切相关,下列用途、性质或变化对应正确的是( )
| A、利用粮食酿酒的化学过程包含:淀粉→葡萄糖→己醇 |
| B、在月饼包装袋中放人生石灰:防止食物氧化变质 |
| C、焰火的绚丽:说明只有金属单质能发生焰色反应 |
| D、氢氧化铝用于治疗胃酸过多氢氧化铝碱性强 |